Corrosion de l’aluminium








Les réactions au cours desquelles des éléments changent de degré d’oxydation sont appelées réactions d’oxydo-réduction.
Exemple : la combustion de l’aluminium donne l’alumine.

Introduction
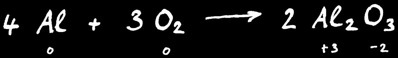
Au cours de cette réactions le degré d’oxydation de l’aluminium à passé de 0 à +3 : on dit qu’il s’est oxydé.
L’oxygène a passé du degré d’oxydation 0 à -2 : on dit qu’il s’est réduit.
Oxydation
Réduction

Définitions
= élévation du degré d’oxydation
= perte d’électrons
= abaissement du degré d’oxydation
= gain d’électrons
La réaction d’oxydation de l’aluminium par l’oxygène donne comme nous l’avons vu un oxyde d’aluminium: l’alumine, qu’on trouve dans le minerai appelé bauxite.

Réaction d’oxydation sans oxygène
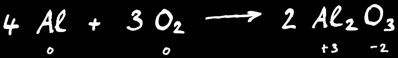
D’après notre définition de l’oxydation, nous pouvons imaginer d’autres réactions d’oxydation de l’aluminium en utilisant d’autres éléments relativement plus électronégatifs. Si nous plongeons une feuille d’aluminium dans une solution aqueuse contenant un sel de cuivre comme le sulfate de cuivre, l’aluminium est oxydé en quelques minutes, sans oxygène.
temps = 0
temps = 5 mn
temps = 10 mn
temps = 15 mn
Explications:
Dissociation électrolytique du sulfate de cuivre en solution aqueuse: les ion Cu++ et SO4-- sont libérés.
Immersion de la feuille d’aluminium: mise en présence du Cu++ et de Al. La réaction d’oxydo-réduction se produit selon l’équation:
Deux réactions se produisent parallèlement:
La réduction du cation Cu++ en cuivre métallique, qui précipite au fond du récipient.
L’oxydation de l’aluminium en ion Al+++. L’ion est dissous dans l’eau ce qui explique l’apparition des trous dans la feuille.
1.
2.
3.

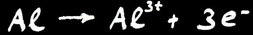



Suite du cours: la combustion
Retour au portail des sciences



Retour au portail de chimie




Suite du cours: oxydation et réduction






