Classification réactions



On remplace dans une molécule, un atome ou un groupe d'atomes par un autre:

Substitution

Addition

Elimination

Isomérisation

Polymérisation

Polycondensation

Combustion

Oxydation ménagée
Il y a réactions entre monomères polyfonctionnels (possédant plusieurs fonctions) avec élimination de n molécules d'eau H2O. Ce sont des réactions complexes.
Des molécules de monomères se soudent les une aux autres pour donner une macromolécule (jusqu'à 10000x plus grosse que le monomère de départ) de polymère .
Exemple:
Il n'y a pas de «rupture» d'une molécule mais simplement formation d'un isomère par réarrangement interne.
Exemple:
Par perte de deux atomes ou groupes d'atomes, il y a création d'une liaison π
Une molécule, après rupture en deux fragments, se fixe à une molécule porteuse d'une double ou d'une triple liaison selon:

les points représentent un électron célibataire.
les flèches indiquent les mouvements des électrons.
les substances les plus touchées par des réactions de substitution sont des hydrocarbures saturés ( alcanes ) ou des dérivés du benzène.
A + B-C --> A-B + C

Exemples:

oxydation
réduction
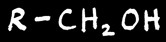
alcool primaire
aldéhyde
alcool secondaire
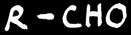

oxydation
réduction
aldéhyde
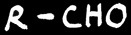
acide carboxylique


oxydation
réduction

Estérification
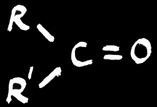
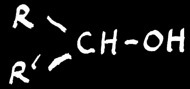
cétone
On peut déterminer trois types de substitutions :
Avec la combustion, nous avons vu des oxydations violentes avec dégagement de chaleur sous forme de flammes. Il existe d’autres types de combustions (combustions lentes, respiration,…) ainsi que des oxydations qui ne mènent pas aux produits ultimes que sont CO2 et H2O: ce sont des oxydations ménagées ou oxydations modérées.
En chimie organique, l’oxydation d’une fonction correspond soit à une augmentation du nombre d’oxygène soit à une diminution du nombre d’hydrogène porté par cette fonction. La réduction est la réaction inverse (plus de H ou moins de O).


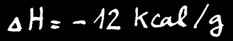

Toutes les substances organiques sont des combustibles: graisses, protéines et sucres,... et donc aussi le bois, le papier, la viande,... Comme toutes ces substances contiennent du carbone (C) et de l’hydrogène (H), on trouve comme produits de la réaction leurs oxydes CO2 et H2O. Si les composés contiennent aussi de l’azote N (amines) ou du soufre S, on trouvera aussi des oxydes NOx et SOx en fin de réaction.
Tout au long de son histoire, l’homme a utilisé des combustibles: bois, charbons, pétrole... qui l’ont accompagné dans ses révolutions industrielles.

Les charbons
Les membres de la famille des charbons sont: la tourbe, le lignite, la houille, l’anthracite. Les charbons proviennent de la décomposition incomplète de la matière végétale (voir carbonifère), ayant pour résultat de concentrer localement le carbone. Les couches de charbons, exploitées depuis le XIXe siècle (révolution industrielle) renferment de nombreux fossiles de plantes. Le meilleur charbon contient beaucoup de carbone et peu d’oxygène. Sa combustion (réaction idéale) s’écrit:

Anthracite
Roche sédimentaire de la famille des charbons formée de débris végétaux ayant subi une évolution complexe (carbonification) au cours de laquelle la matière s’enrichit en carbone. Elle contient 90-95 % de carbone.
Ruhr (Allemagne)

Tourbe
Roche sédimentaire actuelle de la famille des charbons. Formée de débris végétaux en cours de carbonification. Elle contient environ 55 % de carbone.
Isle of Skye (Ecosse)

Les pétroles

L’origine des pétroles (petr-ol, “huile de pierre”) est assez voisine de celle des charbons. Ils sont constitués par des mélanges d’hydrocarbures dont la composition varie avec la provenance géographique. Certains contiennent beaucoup d’alcanes, d’autres sont riches en hydrocarbures aromatiques. La formule générale des alcanes est CnH2n+2. On peut donc écrire l’équation générale de la combustion des alcanes (constituants principaux du pétrole):
Méthane
(gaz naturel)
Octane
(benzine)
Cette réaction est exothermique. Elle dégage environ 12 kilocalories par gramme d’alcane. On peut écrire:
Cette réaction n’a pas un immense intérêt du point de vue chimique puisque la molécule d’alcane est totalement détruite. elle a par contre un immense intérêt pratique et économique. Les alcanes sont notre source principale d’énergie calorifique (mazout), mécanique (essences pour moteurs et réacteurs) et électrique (centrales thermiques).
Exemple de combustion de 2 alcanes: le méthane et l’octane
Remarque: A pression et température normale 1 litre de CH4 brûle dans 2 litres de O2. Comme cette réaction de combustion se fait avec de l’air et non de l’oxygène pur, il faut compter environ 10 litres d’air (puisque l’oxygène représente environ 20 % du volume d’air)
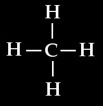
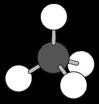

On peut représenter la molécule de méthane de différentes manières:
La formule brute est la représentation la plus simple. C’est elle qui nous permet d’écrire les équations chimiques. Elle permet de savoir que la molécule de méthane est composée d’un atome de carbone et 4 atomes d’hydrogène.
La formule développée met en évidence les liaisons entre atomes. Elle permet de se faire une idée de la structure de la molécule: chaque atome d’hydrogène est lié sur le carbone central.
La représentation 3D permet de se faire une idée plus compliquée mais aussi plus réaliste de la structure spatiale de la molécule: les atomes d’hydrogène occupent les sommets d’un tétraèdre.
Le carbone (combustible) brûle dans le dioxygène (comburant) pour donner un oxyde de carbone. Il y en a deux: le monoxyde de carbone CO et le dioxyde de carbone CO2. Les 2 réactions sont exothermiques.
La proportion de combustible et de comburant joue un rôle considérable dans la combustion. Plus la concentration d'O2 est importante et plus l'équilibre de l'oxydation du carbone est déplacé vers la droite.

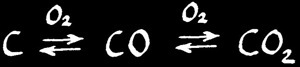





Fin de la page
Suite du cours: Les hydrocarbures
Retour au portail des sciences

Retour au portail de chimie


Remarques :
•
•
•
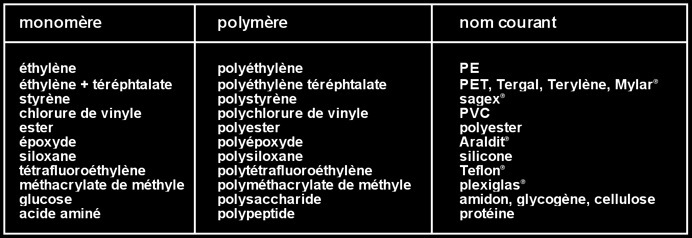
les matières plastiques, les fibres synthétiques et les caoutchoucs synthétiques sont des polymères.
le nom des polymères est tiré du nom du monomère correspondant.
•
•
•
•


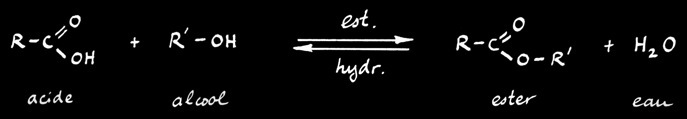

Exemple:
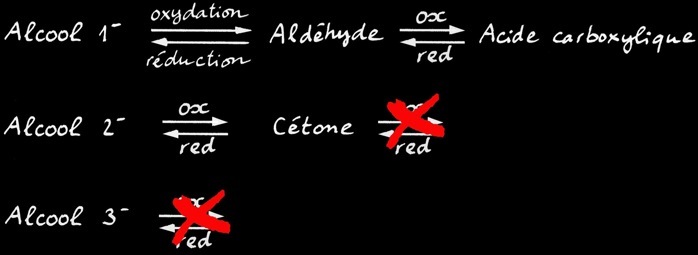
En résumé, on peut écrire le tableau suivant:
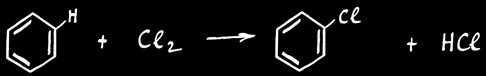
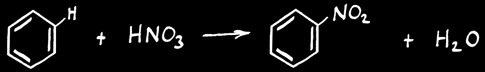
substitution radicalaire :
substitution nucléophile :
substitution électrophile :



•
•
•

Remarque:
Exemples:

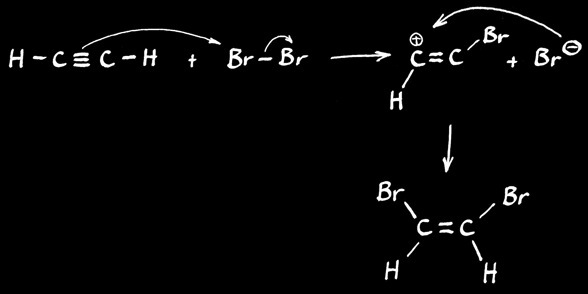

Cette réaction est une addition électrophile
dans le premier exemple ci-dessus, Br2 est un oxydant. Il réalise une attaque électrophile sur C2H2 selon :
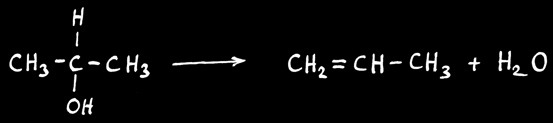
Remarque : l'élimination suit le processus inverse de l'addition.
Exemple:





la polycondensation d'un mélange de dialcools et de diacides peuvent donner naissance à des fibres synthétiques (tergal, terylène, dacron ).





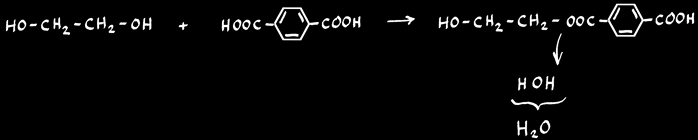
dialcool
diacide

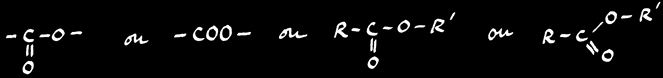
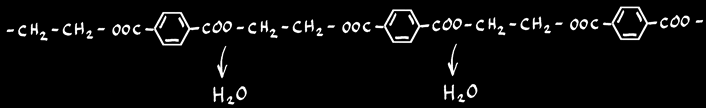
eau



Exemple: