La combustion



La combustion est une réaction chimique au cours de laquelle un combustible est oxydé par un comburant (dioxygène, halogènes,...) avec un grand dégagement d'énergie calorifique (chaleur). Il existe une grande variété de combustibles: bois, papier, pétrole, alcool, graisses, charbon,...
On peut représenter la réaction de combustion par une équation simple:




Toutes les substances organiques sont des combustibles: graisses, protéines et sucres,... et donc aussi le bois, le papier, la viande,... Comme toutes ces substances contiennent du carbone (C) et de l’hydrogène (H), on trouve comme produits de la réaction leurs oxydes CO2 et H2O. Si les composés contiennent aussi de l’azote N (amines) ou du soufre S, on trouvera aussi des oxydes NOx et SOx en fin de réaction.
Tout au long de son histoire, l’homme a utilisé des combustibles: bois, charbons, pétrole... qui l’ont accompagné dans ses révolutions industrielles.

Les charbons
Les membres de la famille des charbons sont: la tourbe, le lignite, la houille et l’anthracite. Les charbons proviennent de la décomposition incomplète de la matière végétale (voir carbonifère), ayant pour résultat de concentrer localement le carbone. Les couches de charbons, exploitées depuis le XIXe siècle (révolution industrielle) renferment de nombreux fossiles de plantes. Le meilleur charbon contient beaucoup de carbone et peu d’oxygène. Sa combustion (réaction idéale) s’écrit:

Anthracite
Roche sédimentaire de la famille des charbons formée de débris végétaux ayant subi une évolution complexe (carbonification) au cours de laquelle la matière s’enrichit en carbone.
Elle contient 90-95 % de carbone.
Ruhr (Allemagne)

Tourbe
Roche sédimentaire actuelle de la famille des charbons. Formée de débris végétaux en cours de carbonification. Elle contient environ 55 % de carbone.
Isle of Skye (Ecosse)


Le pétrole

L’origine du pétrole (petr-ol, “huile de pierre”) est assez voisine de celle des charbons. Il est constitué d’un mélange d’hydrocarbures dont la composition varie avec la provenance géographique. Certains pétroles contiennent beaucoup d’alcanes, d’autres sont riches en hydrocarbures aromatiques. La formule générale des alcanes est CnH2n+2.
Méthane
(gaz naturel)
Octane
(benzine)


Cette réaction est exothermique. Elle dégage environ 12 kilocalories par gramme d’alcane. On peut écrire:
Cette réaction n’a pas un immense intérêt du point de vue chimique puisque la molécule d’alcane est totalement détruite. elle a par contre un immense intérêt pratique et économique. Les alcanes sont notre source principale d’énergie calorifique (mazout), mécanique (essences pour moteurs et réacteurs) et électrique (centrales thermiques).
Exemple de combustion de 2 alcanes: le méthane et l’octane
Remarque: A pression et température normale 1 litre de CH4 brûle dans 2 litres de O2. Comme cette réaction de combustion se fait avec de l’air et non de l’oxygène pur, il faut compter environ 10 litres d’air (puisque l’oxygène représente environ 20 % du volume d’air)
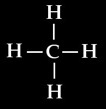
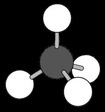

On peut représenter la molécule de méthane de différentes manières:
La formule brute est la représentation la plus simple. C’est elle qui nous permet d’écrire les équations chimiques. Elle permet de savoir que la molécule de méthane est composée d’un atome de carbone et 4 atomes d’hydrogène.
La formule développée met en évidence les liaisons entre atomes. Elle permet de se faire une idée de la structure de la molécule: chaque atome d’hydrogène est lié sur le carbone central.
La représentation 3D permet de se faire une idée plus compliquée mais aussi plus réaliste de la structure spatiale de la molécule: les atomes d’hydrogène occupent les sommets d’un tétraèdre.

Le carbone (combustible) brûle dans le dioxygène (comburant) pour donner un oxyde de carbone. Il y en a deux: le monoxyde de carbone CO et le dioxyde de carbone CO2. Les 2 réactions sont exothermiques.
La proportion de combustible et de comburant joue un rôle considérable dans la combustion. Plus la concentration d'O2 est importante et plus l'équilibre de l'oxydation du carbone est déplacé vers la droite.

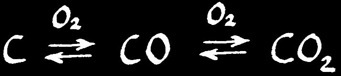




La combustion de la cire de bougie cesse dès qu’on empêche le comburant dioxygène de parvenir sur le lieu de la réaction. Les 200 mL d’air sont consommés en moins de 5 secondes.
Expérience: combustion de l’alcool contenu dans un after-shave.
L’arrivée massive de comburant dioxygène sur le lieu de la réaction favorise la combustion de la cire : la bougie se consume très vite.






Les types de combustibles
Retour au portail des sciences



Retour au portail de chimie




Suite du cours: la liaison chimique



Suite du cours: l’oxydation


La lampe de sûreté
Le grillage serré de cette lampe permet l’arrivée de dioxygène mais empêche la propagation de la flamme hors de la lampe ainsi que l’allumage des poussières de charbon et de grisou (méthane CH4) des mines. Inventée par Humphry Davy vers 1815, elle a sauvé la vie de milliers de mineurs.
Réservoir de combustible
(huile)
Grillage métallique

Mèche





Expérience: Le gaz dihydrogène (combustible) brûle (explose même!) en réagissant avec le dioxygène (comburant) pour donner un oxyde d'hydrogène: l'eau (à l’état gazeux)


Comment éteindre une flamme ?
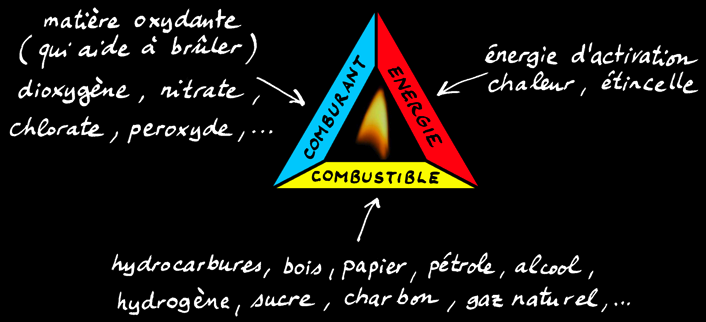




Le triangle de feu
Il faut réunir 3 conditions pour avoir une flamme:
Une substance combustible. C'est elle qui brûle en s'oxydant lors de la combustion.
Exemples: papier, bois, charbons (tourbe, lignite, houille, anthracite), hydrocarbures (pétrole, gaz naturel), substances organiques (graisses, protéines, sucres),...
Un comburant. C'est la substance qui aide à brûler en oxydant le combustible.
Exemples: oxygène (dioxygène), peroxydes (eau oxygénée), chlorates, nitrates, halogènes (chlore), ...
L'énergie. Elle sert à amorcer la réaction et à l'entretenir.
1.
2.
3.
X
X
X
Il faut éliminer l'un des côté du «triangle de feu» et empêcher la réaction entre le combustible et le comburant. Si on peut isoler (ou éliminer) l’un des deux réactifs, la réaction chimique n’a pas lieu.

1.
On peut retirer ou éloigner le combustible du lieu de la réaction (fermer l'arrivée de gaz, ...)
Empêcher le comburant d'être en contact avec le combustible:
2.
en jetant sur le feu une couverture,
du sable, de la terre,...
en projetant un gaz inerte (CO2):
il ne réagit pas et prend la place de l'oxygène
•
•
La meilleure solution reste souvent d'absorber ou de retirer une partie de l'énergie produite par l'incendie:
3.
en jetant de l'eau sur le feu. L'eau absorbe énormément de chaleur pour se transformer en vapeur.
en jetant de l'eau avec un additif (mousse).
•
•



Fin de la page
On peut représenter cette réalité sous la forme d’un triangle:

Mortel CO2
Qu'est-ce que le CO2 ?
Le dioxyde de carbone (gaz carbonique ou anhydride carbonique) est une substance dont la formule chimique est CO2. La molécule de CO2 a une structure linéaire de la forme O=C=O. Il se présente, sous les conditions normales de température et de pression (TPN), comme un gaz incolore, inodore, à la saveur piquante.
L'air (atmosphère terrestre) contient 0,04 % de CO2. On peut donc dire que sa concentration dans l’air vaut 0,04 % (en volume). Il joue un rôle important dans le réchauffement climatique. Il est légèrement plus lourd que l’air et peut donc se concentrer dans des locaux mal aérés (cave à vin, silo,...).
Comment rencontrer le CO2 ?
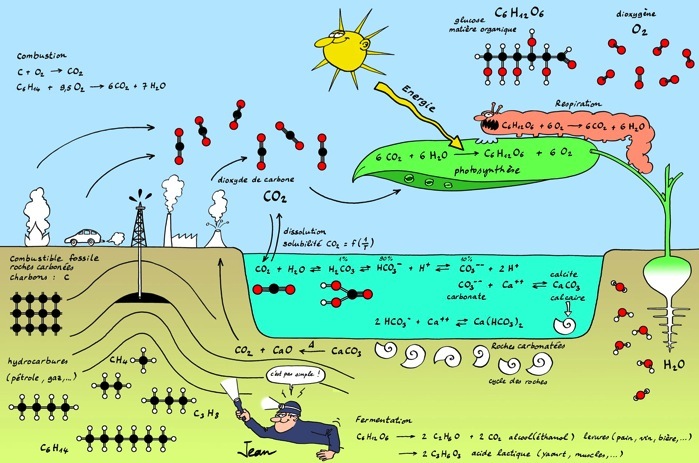
Le CO2 est un élément fondamental du cycle du carbone sur notre planète:
Il est consommé par les végétaux pour produire de la biomasse grâce à la réaction de photosynthèse.
Photosynthèse:
Il est produit par l'oxydation des glucides et des lipides (matières organiques contenant du carbone) lors de la respiration des cellules vivantes (animaux, végétaux, levures et champignons) ou de la fermentation (oxydation sans oxygène):
Respiration cellulaire:
Fermentation alcoolique:
Il est produit par la combustion des charbons, du gaz naturel et du pétrole (combustibles fossiles) et d'autres matières combustibles lors des incendies.

Combustion du méthane:
Combustion du charbon:
Il est rejeté aussi par les volcans.
extinction des feux ( dans les extincteurs)
production de boissons gazeuses (bulles pétillantes et acides)
culture sous serre (augmente la croissance des plantes en favorisant la photosynthèse.
atmosphère sans oxygène (emballages «sous vide»)
systèmes de refroidissements (industrie électronique, congélation des aliments) sous forme liquide ou solide: on l’appelle alors «glace carbonique, neige carbonique, carboglace ou glace sèche». La glace carbonique se sublime à très basse température (T= -78,5°C ) à la pression atmosphérique (P=1 atm) sans laisser de traces. Son enthalpie de sublimation vaut 25,2 kJ par mole (25,2 kJ·mol-1).
agent propulseur (liquides sous pression) qui évite les problèmes d’oxydation des compresseurs utilisant de l’air (-> meilleure conservation).
•
•
•
•
•
•
Quelques utilisations du CO2
Danger d'asphyxie
L’asphyxie est provoqué par une mauvaise alimentation du corps en oxygène. Il mène à l'inconscience puis à la mort. Au-delà de quelques minutes, il entraîne des séquelles irréversibles au cerveau. Les causes de l'asphyxie sont multiples: suffocation, noyade, strangulation, écrasement du thorax, confinement (dans un sac plastique, une avalanche) et inhalation de gaz irrespirables.









Le cycle du carbone

Suite du cours: moteur et combustion

Calorimétrie: combustion d’une amande


Expérience


Le 21 août 1986, au Cameroun, le Lac Nyos, un lac de cratère volcanique a rejeté 1 milliard de m3 de CO2 (un kilomètre cube), ce qui a provoqué la mort de 1800 personnes et des milliers d'animaux.


Dans ce document trouvé sur internet, il y a une erreur : trouve-la !



Expérience: asphyxie d’une flamme

Expérience: combustion accélérée d’une flamme
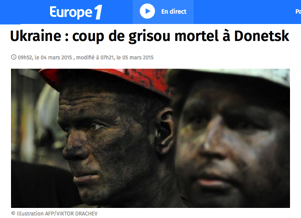

L’exploitation du charbon a permis la première révolution industrielle. Mais les mines ont été le théâtre de terribles accidents. Le grisou, composé presque exclusivement de méthane CH4 est emprisonné dans les veines de charbon. Lors de la fracturation de la roche, il se répand dans les galeries mal aérées et peut exploser à n’importe quel moment.

La photo de droite montre des cercueils devant une mine de charbon à Dortmund en Allemegne suite au «coup de grisou» qui tua 130 mineurs en février 1925.
Le grisou continue de tuer dans d’autres régions du monde.

Locomotive à vapeur Liestal-Waldenburg (1912)

Locomotive «The Rocket» de Stephenson, 1829
L’exploitation du charbon a eu une grande importance lors de la révolution industrielle du 19e siècle. En effet, la production d’acier (alliage de fer et de carbone) a permis de développer les «chemins de fer». Les premières locomotives utilisaient en plus le charbon comme combustible.
Humphry Davy (1778-1829)
Peinture de Thomas Phillips (1821)


Raffinerie Tamoil de Collombey en 2014. Elle a fermé en 2015


Cet hydrocarbure est un alcane formé de 6 atomes de carbone et 14 atomes d’hydrogène. Il s’appelle hexane («hexa» veut dire 6 en grec). Sa formule chimique s’écrit C6H14. On en trouve dans l’essence extraite du pétrole.
On peut écrire l’équation générale de la combustion des alcanes (constituants principaux du pétrole):
La réaction de combustion d’un hydrocarbure ne rejette idéalement que du dioxyde de carbone CO2 et de la vapeur d’eau H2O. En réalité l’efficacité des brûleurs et des moteurs n’est pas optimale: la réaction de combustion n’est pas parfaite et des «bribes» d’hydrocarbures incomplètement oxydés réagissent pour former une poussière noire de particules fines de suie.

Combustion et pollution
L’ange de la photo a été sculpté dans une roche calcaire. Recouvert de suie noire par la pollution, il a été ensuite rongé par la pluie légèrement acide qui lui redonne sa couleur blanche.

La flamme du chalumeau oxyhydrique
Mon chalumeau bricolé à partir d’un stylo à billes opère un mélange de gaz dihydrogène H2 et dioxygène O2.




La combustion du dihydrogène H2 ne produit pas de dioxyde de carbone mais de la vapeur d’eau (le monoxde de dihydrogène). La réaction est très exothermique. On obtient une flamme de 2500°C. L’équation chimique s’écrit:






Système initial: les réactifs
Système final: les produits
Réaction
2 molécules de dihydrogène et
1 molécule de dioxygène
2 molécules de vapeur d’eau

Il faut mélanger les gaz dans un rapport stoechiométrique: 2 volumes de dihydrogène H2 pour 1 volume de dioxygène O2.





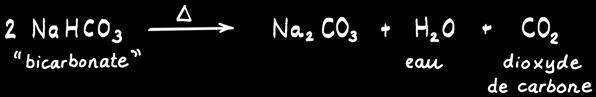
Comment un extincteur à poudre à base de bicarbonate de sodium fonctionne-t-il ? La réaction suivante devrait t’aider :
«Le feu face aux pompiers», un film de la série «C’est pas sorcier»