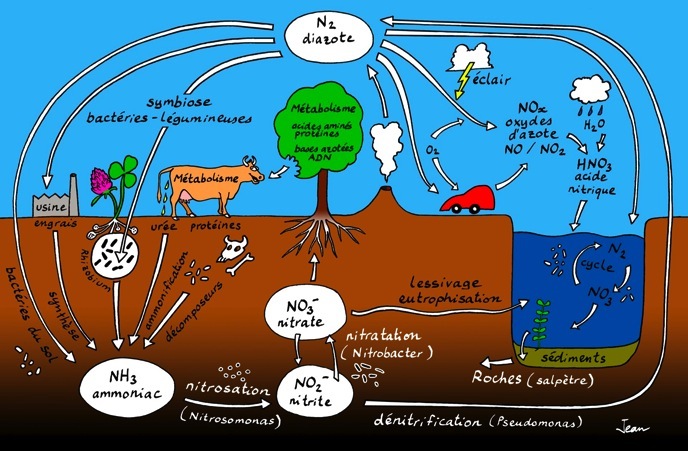
Cycle de l’azote



Fin de la page
Retour au portail de biologie






Retour au portail de physique

Retour au portail des sciences



Retour au portail de géologie



Retour au portail de chimie





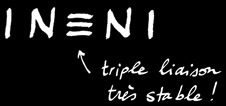
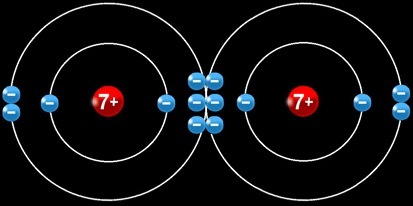
L’atome d’azote



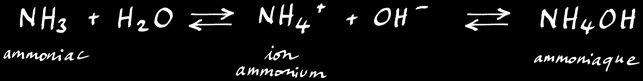




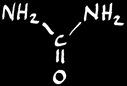

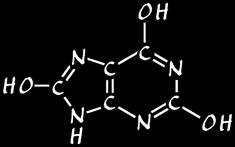
acide urique
urée
L’atmosphère contient aussi des oxydes d'azote «NOx», des molécules de gaz formés d’atomes d’azote (N) et d’oxygène (O). Le monoxyde d’azote (NO) et le dioxyde d’azote (NO2) sont très réactifs et toxiques. Ils se forment par oxydation du diazote à haute température dans les moteurs thermiques, les feux et les éclairs. C’est l’une des sources principale de pollution. Le dioxyde d’azote (NO2) réagit avec l’humidité de l’air pour former de l’acide nitrique (HNO3) qui retombe sur Terre sous forme de pluies acides.

L’azote atmosphérique
L’azote est indispensable aux êtres vivants. Il entre dans la composition de substances vitales:
les acides aminés qui s’assemblent pour former des protéines.
les bases azotées qui forment les acides nucléiques (ADN et ARN).
•
•

L’air
La pression atmosphérique est exercée par l'air qui nous entoure. L'air est formé de très nombreux petits "grains" invisibles à l'oeil nu qu'on appelle molécules. L'air sec est un mélange homogène de différents gaz. La composition (% du volume) de l’air sec non pollué est la suivante:



Autre gaz: argon, dioxyde de carbone,..1 %
Diazote 78 %
Dioxygène 21 %



= 14 nucléons
(protons + neutrons)
= 7 protons dans le noyau
= 7 électrons dans l’enveloppe électronique




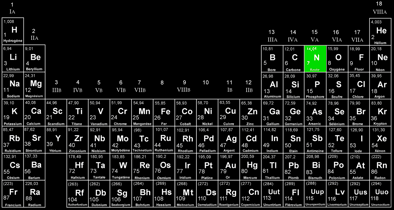
L’azote est l’une des briques de la matière. L’élément chimique azote (N) comme la centaine d’autres éléments chimiques, peut être représenté avec ses caractéristiques dans un «tableau périodique des éléments».
La fixation de l'azote gazeux N2 dans la matière vivante n’est possible qu’à certaines bactéries qui produisent une enzyme (la nitrogénase) qui permet de réaliser la synthèse de l'ammoniac à une température et une pression normale.
La plupart des êtres vivants sont incapables d’utiliser directement le diazote présent dans l’air.
L'ammoniac NH3 et l’ion ammonium NH4+ se forment par décomposition de l'urée et de l'acide urique. L’urée subit une hydrolyse, catalysée par l'enzyme uréase selon la réaction :
La nitrification se déroule en deux étapes, réalisées par deux populations bactériennes différentes. Une première étape de nitritation oxyde l'amoniac en nitrite, consommant une molécule d'oxygène par molécule formée :
Les nitrites sont ensuite transformés en nitrates selon la réaction:

L’azote dans les êtres vivants

La nitrification

La nitratation

Masse atomique

numéro atomique

symbole de l’élément
«N» pour nitrogène
diazote
ammoniac
dihydrogène


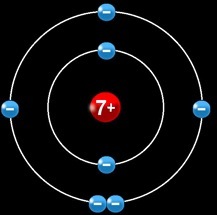
L’élément azote regroupe tous les atomes qui possèdent un noyau qui contient 7 protons (chargés positivement). Un atome d’azote électriquement neutre compte 7 électrons chargés négativement en mouvement autour du noyau.
L’azote entre dans la composition d’une multitude de substances qu’on retrouve sous forme de minéraux, de gaz, de matière vivante (protéines, ADN,...). Cette image propose une vision générale et simplifiée du cycle de l’azote. On peut l’agrandir en cliquant dessus.
Les acides aminés, les protéines, les bases azotées