L’eau dans tous ses états

Fusion et ébullition de l’eau




1.
2.
3.
4.
5.
On peut trouver l’eau sous 3 formes différentes: solide (glace), liquide ou gazeuse (vapeur). Ce sont 3 états de la matière.
de l'eau glacée (avec glaçons)
1 bec Bunsen
1 thermomètre
1 allume-gaz
1 morceau de mousse
1 trépied
1 noix double
1 becher 400 ml
1 petite pince


Chauffer de l'eau et observer les transformations.
Mesurer la température de l'eau en cours de chauffage (chaque minute).
Déterminer la température d'ébullition de l'eau.
Apprendre à rédiger un rapport de sciences.



Au début de l'évaporation, on voit de la buée sur le bord du becher: l'eau qui vient de passer en phase vapeur redevient liquide au contact des parois plus froides du becher.
L'eau s'évapore au cours du chauffage: son niveau baisse:
On voit apparaître aussi des sortes de vagues à l'intérieur de l'eau. Il s'agit de couches d'eau à différentes températures rendues visibles par leur indice de réfraction différent.
Le dépôt blanc sur les parois du becher après évaporation de l'eau est du calcaire CaCO3. Nous le prouvons en le faisant réagir avec de l'acide chlorhydrique (HCl).
Des bulles apparaissent avant la température d’ébullition sur le fond du becher. En effet l’eau en contact avec le verre chauffé absorbe plus d’énergie et peut passer à l’état gazeux. Localement on atteint cette température d’ébullition mais le thermomètre mesure une température plus basse au milieu du liquide.
1.
2.
3.
4.
5.
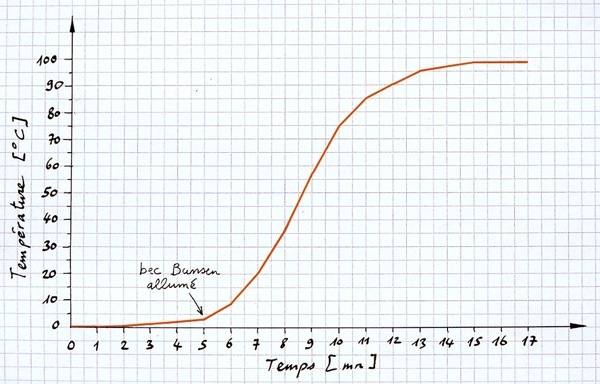
Plus on chauffe l'eau, plus sa température monte. C’est simple mais ça se complique...
La variation de température n’est pas linéaire (ligne droite) mais laisse apparaître des paliers: température de fusion et température d’ébullition. Sur ces paliers, l’énergie reçue par l’eau ne sert pas à augmenter l’agitation des molécules (et donc la température) mais à changer les “liaisons” entre ces molécules. Un apport de chaleur ne se traduit donc pas toujours par une augmentation de température !!!
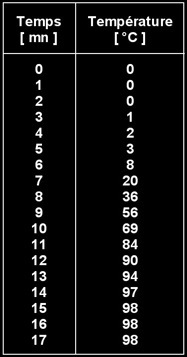
La température se stabilise à une certaine valeur qu'on appelle température d'ébullition. Elle vaut 98°C à Béthusy (550 m d'altitude). C'est au bord de la mer (0 m d'altitude) que la température d'ébullition de l'eau vaut 100°C.
La quantité d'eau utilisée n’a pas d’influence sur la température d'ébullition: environ 98°C. La qualité des thermomètres utilisés et de la position de ceux-ci dans le becher peuvent mener à quelques variations.
Les bulles qui s’échappent du liquide ne sont pas des bulles d’oxygène mais d’eau à l’état gazeux.
1.
2.
3.
4.
5.
6.
Réaliser le montage selon le dessin.
Mettre de l'eau gelée dans le becher. Chaque groupe prend une quantité différente.
Mesurer la température de l'eau.
Allumer le gaz puis ouvrir l'entrée d'air (flamme bleue).
Mettre la flamme sous le trépied et enclencher simultanément le chronomètre.
Mesurer la température chaque minute pendant 17 minutes.
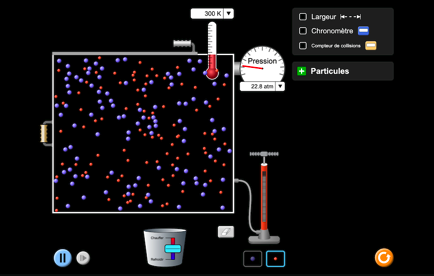
On peut simuler sur un ordinateur la trajectoire des molécules d’eau:
Dans un solide dans un liquide dans un gaz

Retour au portail des sciences



Retour au portail de chimie



Suite du cours: les états de la matière





Buts de l'expérience
Matériel

Introduction

Méthode

Résultats

Remarques

Conclusions
1.
2.
3.
4.




Remarques





protocole
rapport
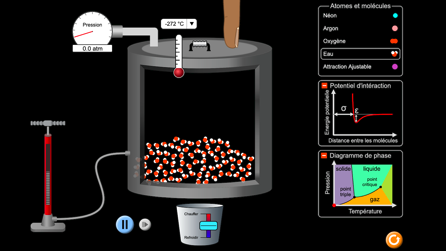
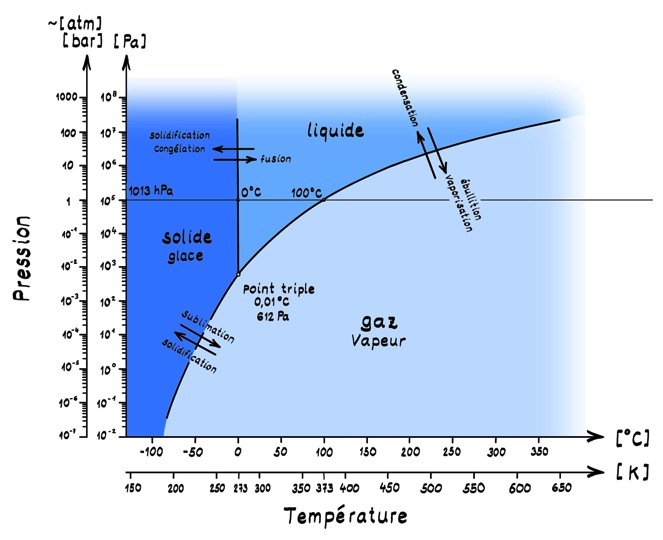
Les surfaces représentent les conditions de stabilité de chaque état.
Les changements d’état ont lieu sur les lignes à la frontière de ces surfaces.
La ligne horizontale à 1013 hPa correspond à la pression atmosphérique «normale» au bord de la mer à zéro mètres d’altitude.

L’eau dans tous ses états
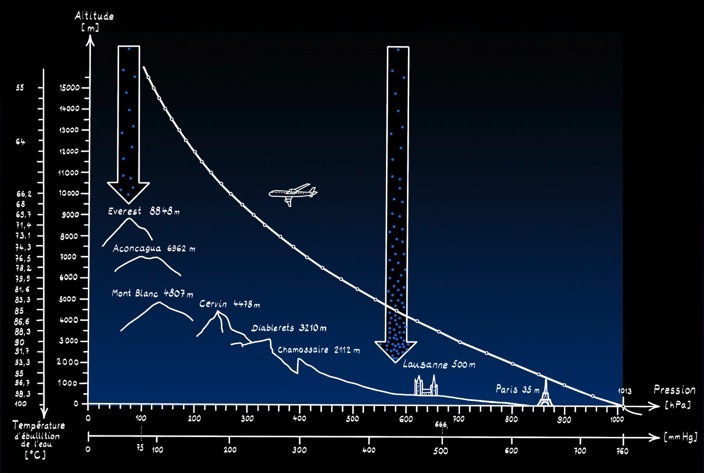
Les molécules d'air «s'entassent» sous l'effet de l'attraction terrestre le plus «bas» possible: dense au bord de la mer, l'air se raréfie avec l'altitude. La pression atmosphérique diminue avec l'altitude. La pression atmosphérique est plus grande au bord de la mer qu'au sommet d'une montagne. Au bord de la mer la colonne d’air qui est au-dessus de nous est plus haute: elle exerce donc sur nous une plus grande pression.

haute pression
basse pression
molécules d'air






Animation «états de la matière»


Animation «gaz»