Les électrolytes

Quand un métal forme deux oxydes , on regarde son degré d’oxydation :
Le plus bas degré d’oxydation donne la terminaison ... eux
Le plus haut degré d’oxydation donne la terminaison ... ique
Cu2O = 2 Cu+ + O--
Le cuivre est au degré d’oxydation +1 ( son plus bas degré d’oxydation )
On dit oyxde de cuivre 1 ou oxyde cuivreux
CuO = Cu++ + O--
Le cuivre est au degré d’oxydation +2 ( son plus haut degré d’oxydation )
On dit oyxde de cuivre 2 ou oxyde cuivrique
FeO est donc l’oxyde de fer 2 ( ferreux )
Fe2O3 est l’oxyde de fer 3 ( ferrique )




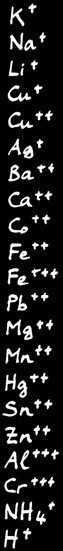
Potassium
Sodium
Lithium
Cuivre I (cuivreux)
Cuivre II (cuivrique)
Argent
Baryum
Calcium
Cobalt
Fer II (ferreux)
Fer III (ferrique)
Plomb
Magnésium
Manganèse
Mercure
Etain
Zinc
Aluminium
Chrome III (chromique)
Ammonium
Ion hydrogène (acide)
Fluorure
Chlorure
Bromure
Iodure
Sulfure
Oxyde
Hydroxyde
Cyanure
Nitrite
Nitrate
Chlorate
Perchlorate
Manganate
Carbonate
Hydrogénocarbonate
Chromate
Phosphate
Sulfite
Sulfate
Acétate

On a donné ce nom à ces corps car ils permettent d’obtenir des solutions qui conduisent l’électricité.
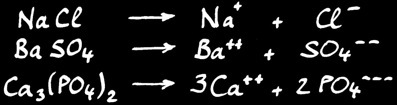
Les principaux électrolytes sont les acides, les bases, les hydroxydes, les sels et les sels acides.

Définition
Ce sont les substances qui sont capables de donner des cations H+.
Exemples:

Les acides

Ces équations décrivent des réactions fictives. En effet, l’acide, donneur de proton H+, a besoin d’un accepteur de H+ pour qu’une réaction puisse avoir lieu.
Ce sont les substances qui sont capables d’accepter des protons H+.
Exemples:

Les bases
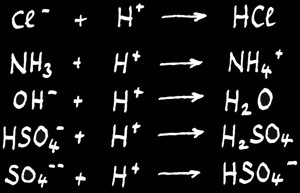
Ces équations décrivent aussi des réactions fictives. En effet, la base ( accepteur de proton H+ ) doit être mise en présence d’un acide ( donneur de proton H+ ) pour qu’il y ait une réaction.
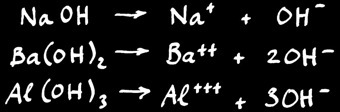
Ce sont les électrolytes dont la partie négative est l’anion OH -
Exemples:

Les hydroxydes
Ce sont les électrolytes dont la partie négative est différente de l’anion OH - et la partie positive différente du cation H+.
Exemples:

Les sels
Certains sels contiennent encore un cation H+ protolysable dans la partie anionique: on les appelle des sels acides .
Exemple:
Cations ( = ions positifs )

Quelques ions qu’on retrouve souvent
Anions ( = ions négatifs )
H+ protolysable
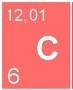
Ce sont les produits de la réaction d’oxydation entre l’oxygène et un autre élément. On distingue les oxydes de métaux des oxydes de non-métaux.

Les Oxydes
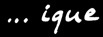

Oxydes métalliques ( = oxydes de métaux )
Ce sont des composés de l’oxygène avec un métal: ils réagissent avec l’eau pour former un hydroxyde.
Exemple:
Na2O + H2O = 2 NaOH
MgO + H2O = Mg(OH)2
Anhydrides ( = oxydes de non- métaux )
Ce sont des composés de l’oxygène avec un non-métal : ils réagissent avec l’eau pour former un oxacide : un acide qui contient de l’oxygène.
Exemple:
SO2 + H2O = H2SO3
N2O5 + H2O = 2 HNO3
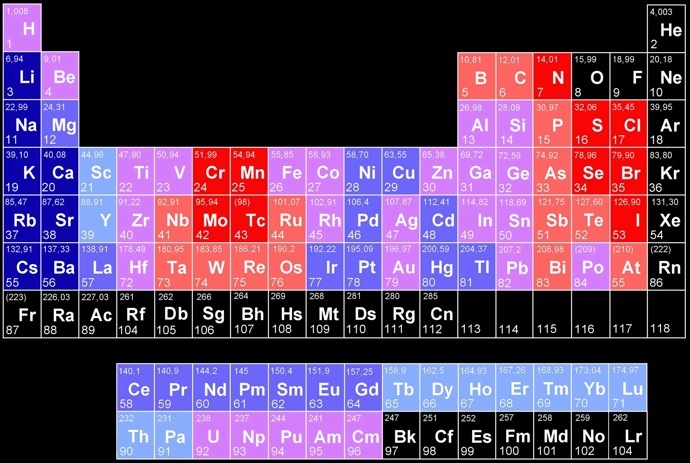

Propriétés acido-basiques des oxydes des éléments






Les éléments ont des oxydes de plus en plus acides
Les éléments ont des oxydes de plus en plus basiques
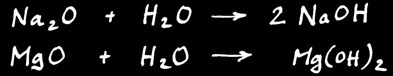
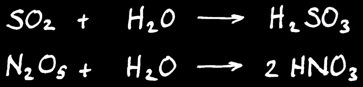

Cette page est en travaux. Bientôt la suite...

Les électrolytes sont des substances qui font apparaître des ions (particules chargées) en solution aqueuse (dans l’eau) .

Les électrolytes ont des noms exotiques mais qui ne manquent pas de poésie :
Le monohydrogénophosphate de calcium , l’acide hypochloreux ,...
Pour s’y retrouver il faut appliquer certaines règles. Commençons par les oxydes.

Nomenclature
Nom des
oxydes
On utilise le terme d’oxyde suivi du nom du métal. Quand un métal ne forme qu’un seul oxyde c’est facile:
Na2O = oyxde de sodium
BaO = oxyde de baryum
CaO = oxyde de calcium
Nom des anhydrides
On utilise le terme d’anhydride suivi du nom du non-métal. On utilise les terminaisons -eux et -ique .
SO2 = anhydride sulfureux
SO3 = anhydride sulfurique
Certains non-métaux forment plus de 2 anhydrides : ça se complique... On utilise alors les préfixes -hypo et -per .
degré
d’oxydation
+7
+5
+3
+1
anhydride
Cl2O7
Cl2O5
Cl2O3
Cl2O
nom
anhydride per...chlor...ique
anhydride chlor...ique
anhydride chlor...eux
anhydride hypo...chlor...eux
Exemple : les anhydrides du chlore .
Retour au portail des sciences



Retour au portail de chimie



Suite du cours: les solutions




Suite du cours: l’électronégativité













Fin de la page