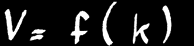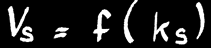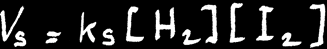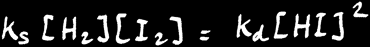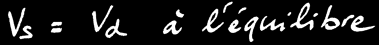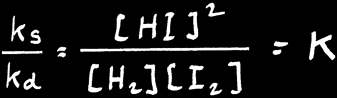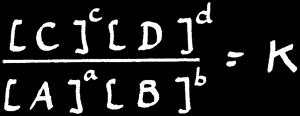Equilibre






Retour au portail des sciences



Retour au portail de chimie



Suite du cours: la liaison chimique



Suite du cours: déplacement d’équilibre


Fin de la page

Les réactions irréversibles
Nous avons déjà étudié des réactions chimiques. Jusqu’à présent, nous n’avons rencontré que des réactions irréversibles c’est à dire des réactions totales: les réactifs du système initial réagissent et disparaissent totalement du champ réactionnel pour faire place aux produits plus stables du système final.
Représentons les réactifs par des lettres A et B, ainsi que les produits par C et D:
système initial
système final
aA + bB ---> cC + dD
La réaction irréversible est symbolisée par une flèche à sens unique liant le système initial au système final.
Remarque :
les lettres minuscules représentent les coefficients stoechiométriques qui permettent de rendre une équation quantitativement juste.
Les réactions réversibles
Lors de certaines réactions, les substances du système initial et final coexistent dans le champ réactionnel: la réaction n’est donc pas totale.
En effet, les molécules du système final réagissent entre elles pour redonner les molécules du système initial. Il y a donc 2 réactions de sens contraire, faisant intervenir les mêmes substances:
L’équilibre chimique dépend de la vitesse des réactions 1) et 2): il est donc indispensable de définir avant tout la notion de vitesse de réaction.
-
1)
2)
Lorsqu’on a affaire à de tels équilibres, on représente la réaction réversible par une double flèche, et on peut écrire:
Vitesse de réaction
La vitesse d’une réaction chimique (V) dépend de plusieurs facteurs:
la température : V = f (k)
autrement dit, la vitesse de réaction est fonction d’un facteur «k» qui ne dépend que de la température. Plus la température est élevée, plus la vitesse de réaction est grande.
les concentrations :
la vitesse de réaction est fonction de la quantité des réactifs présents à raison du produit de leurs concentrations.
Exemple :
La réaction de synthèse de l’iodure d’hydrogène (ou acide iodehydrique):
La vitesse de synthèse de HI dépend de la température et des concentrations des réactifs H2 et I2:
Vs est fonction du produit des concentrations de H2 et de I2.
On peut donc écrire:
H2 + I2 ---> 2 HI
Après un certain temps, les molécules de HI formées se décomposent sous l’effet des chocs engendrés par les autres molécules pour redonner H2 et I2 avec une vitesse de décomposition Vd.
Alors:
ou
Finalement, l’équilibre s’installe et on peut écrire:
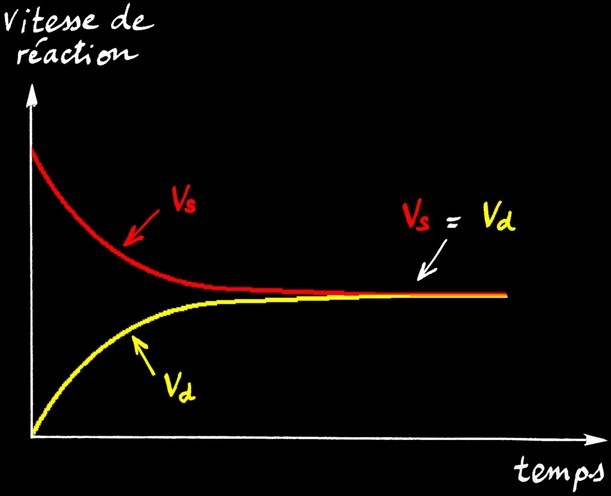
L’équilibre chimique est caractérisé par la relation : Vs = Vd
En effet, lorsque l’équilibre est atteint, le nombre de molécules de HI formées est égal au nombre de molécules de HI décomposées.
Evolution des vitesses de réaction Vs et Vd
en fonction du temps

Puisque
on peut aussi écrire:
Donc :
K est la constante d’équilibre de Guldberg et Waage
Loi d’action des masses
On peut généraliser cet exemple en prenant l’équilibre:
Le rapport des concentrations à l’équilibre est donné par la loi d’action des masses: