Les 3 états de la matière











La matière qui nous entoure peut prendre diverses formes. On distingue en première approche 3 états de la matière: solide, liquide et gaz. Nous verrons plus loin qu’il existe encore d’autres états (plasma, cristaux liquides,...) mais pour le moment contentons-nous de ces trois-là.

Solide, liquide & gaz
L’état solide
Les changements d’état




La même substance peut changer d’état. On parle aussi de transition de phase. Ces changements d'état sont provoqués par une variation de température ou de pression. Souvent la pression ne joue pas de rôle puisqu'elle varie peu (pression atmosphérique).


Dans la réaction chimique ci-dessous, on voit le sulfure de fer (solide) réagir avec l’acide chlorhydrique (liquide) pour former des bulles de sulfure d’hydrogène (gaz). Chacune des 3 substances se trouve dans un état différent.


Suite du cours: techniques de séparation
Retour au portail de chimie



Ebullition de liquides inflammables


Température d’ébullition de l’eau

Expérience

Expérience

Fusion du plomb & moulage

Expérience




Si on prend un glaçon dans le congélateur et qu'on le dépose dans un verre, il va se réchauffer, fondre et prendre toute la place disponible au fond du verre. Si on chauffe cette eau, elle va bouillir et disparaître dans l'atmosphère sous forme de gaz (vapeur). La même substance (l'eau) peut donc se trouver sous 3 formes différentes (on dit 3 états):



solide
liquide
gaz

Expérience
Sous l’effet de la chaleur, le plomb change d’état. A 328°C, il passe de l’état solide à l’état liquide: il se met à couler au fond de la casserole en aluminium.

Expérience
Quelle est la température de fusion du fer?
A quelle température bout l'aluminium?
Quel est l'état à 1300°C du fer? du mercure? du plomb? de l'or?
A quelle température bout le mercure?
Lorsque nous rencontrons de l'étain liquide, quelle est sa température?
Quel est l'état à 2000°C de l'argent? du fer? du mercure?
Quel métal de l'étain, de l'aluminium ou de l'or conviendra le mieux pour fabriquer des casseroles?
Répondre aux questions en se basant sur le tableau suivant:















augmentation de la température
Dans un solide cristallin, les atomes sont bien rangés selon des formes géométriques simples comme le cube. Il existe 7 systèmes cristallins dans la nature:
1 atome


Les propriétés physiques d’un cristal varient...
... quand on l’étudie sous différents angles.


ne possède ni forme ni volume propre: il occupe tout le volume disponible.
est désordonné: ses constituants sont très faiblement liés, presque indépendants.

L’état liquide
possède une masse et un volume propres.
n’a aucune rigidité. Sa forme dépend des forces qui s’exercent sur lui: la pesanteur l’oblige à s’étaler sur une surface plane ou prendre la forme du récipient qui le contient. En état d’apesanteur, un liquide prend une forme sphérique sous l’effet des forces de cohésion.
•
•
•
Le liquide ...

L’état gazeux
•
•
Le gaz ...



Clique sur l’état gazeux



Clique sur le système en ébullition





Clique sur la matière qui est en train de fondre












Exercice sur papier
Peut on fondre du plomb dans une casserole en étain?
Si le plomb est liquide, que peut-on dire de sa température?
Non: l'étain fond avant le plomb.
Oui: il suffit de chauffer longtemps.


Elle est plus élevée que 500°C
Elle est plus élevée que 1749°C


Elle est comprise entre 328 et 1749°C

Le fer, car il fond à 1538°C. L’argent liquide est très difficile à obtenir.
De l'argent ou du fer, lequel est le plus facilement liquéfiable?
L'argent. Il fond déjà en dessous de 1000°C contrairement au fer.





Quel est le meilleur métal pour fabriquer le filament d’une ampoule à incandescence?
Le plomb car il fond facilement.
L’argent car c’est lui qui brille le mieux.

Le tungstène car il a la température de fusion la plus élevée.

L’aluminium car il est plus léger.

Le fer car il n’est pas cher.






filament


Expérience


Le filament d’une ampoule à incandescence est en tungstène, un métal qui ne fond qu'à très haute température (plus de 5000 °C). Il est porté ici à 2700°C.


cubique
rhomboédrique
orthorhombique
monoclinique
triclinique
quadratique
hexagonal
La pyrite (sulfure de fer FeS2) cristallise dans l’un de ces systèmes. Lequel? Clique dessus.




1.
2.
3.
4.
5.
6.
7.
Retour au portail des sciences



Retour au cours de géologie








•
•
•
Le solide ...
possède une masse.
a une forme rigide grâce à ses importantes forces internes de cohésion qui lui permettent de résister aux contraintes extérieures. Mais il peut aussi parfois se déformer grâce à son élasticité.
occupe un volume propre. Il varie peu avec la pression (incompressible) et la température (il se dilate un peu quand on le chauffe).
est ordonné: ses constituants sont fortement liés entre eux et sont souvent rangés selon des formes géométriques (dans le cas des cristaux et des métaux).
a une grande densité. Sa masse volumique (rapport masse/volume) est caractéristique de la substance et dépend un peu de la température. Elle est comprise entre 500 [g/dm3] pour le lithium et 23000 [g/dm3] pour l’osmium.
•
•
est moins bien ordonné: ses constituants sont faiblement liés: contrairement à l'état solide, ils glissent les uns sur les autres.
a une grande densité. Sa masse volumique (rapport masse/volume) est comparable à celle des solides. Il faut se rappeler que celle de l’eau vaut par définition 1000 [g/dm3].
•
•
a une faible densité. Sa masse volumique (rapport masse/volume) dépend de la température et de la pression. Dans les conditions ambiantes elle vaut 0,08 [g/dm3] pour le dihydrogène et 1,3 [g/dm3] pour l’air. Un gaz plus lourd comme le CO2 a une valeur de 1,8 [g/dm3]. Un gaz très dense comme le radon n’a qu’une masse volumique de 9,7 [g/dm3].
•
Comme l'état liquide, l'état gazeux est un état fluide.
Quand on chauffe une substance solide, on augmente son énergie interne. On remarque généralement une élévation de la température ainsi qu’une dilatation. Quand on atteint une certaine température (toujours la même pour une certaine substance) la matière change d’état: fusion ou sublimation pour un solide et vaporisation pour un liquide. Par refroidissement on assiste au changement d’état inverse. La même substance peut ainsi changer d’état indéfiniment. Ces changements d'état sont provoqués par une variation de température et de pression. Souvent la pression ne joue pas de rôle puisqu'elle varie peu (pression atmosphérique).
Par ébullition. A la température d’ébullition, déterminée par la pression et la nature du liquide, des bulles de gaz naissent à l’intérieur du liquide et s’échappent.
Par évaporation à la surface du liquide, à nimporte quelle température. C’est ainsi qu’une flaque ou un linge de bain mouillé sèche à une température inférieure à la température d’ébullition de l’eau (100°C).
Remarque:
La vaporisation peut se réaliser de 2 façons très différentes
•
•



Dans un gaz, les atomes ne restent plus à proximité les uns des autres. Leur énergie leur permet de parcourir de plus grandes distances entrecoupées par des chocs.
Dans un solide, plus la température augmente, plus les atomes s’agitent dans tous les sens autour d’une position d’équilibre.
Dans un solide à la température de zéro absolu (environ -273°C), il n’y a pas de mouvement: chaque trajectoire est figée. Une photo des atomes les montre bien rangés dans leur cristal.
Dans un liquide, l’énergie est telle que les atomes perdent leur position “définie” et se mettent à glisser les uns contre les autres. Le solide se met à couler.

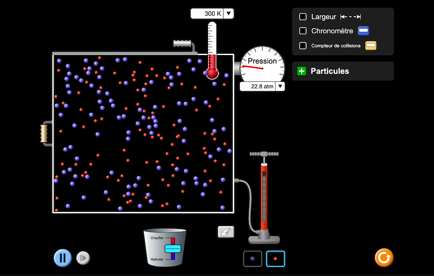
On peut simuler sur un ordinateur la trajectoire des atomes d’une substance à différentes températures.

solide froid
solide chaud

liquide

gaz
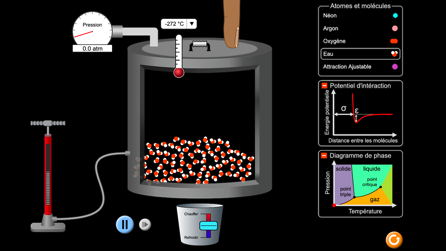
L’état d’une substance est déterminé par 2 grandeurs physiques: la température et la pression. On peut représenter les domaines d’existence des différents états d’une substance au moyen d’un diagramme d’état selon 2 axes (pression et température).

Diagramme d’état
Les surfaces représentent les conditions de stabilité de chaque état.
Les changements d’état ont lieu sur les lignes à la frontière de ces surfaces.
La ligne horizontale à 1013 hPa correspond à la pression atmosphérique «normale» au bord de la mer à zéro mètres d’altitude.















L’eau dans tous ses états
Les molécules d'air «s'entassent» sous l'effet de l'attraction terrestre le plus «bas» possible: dense au bord de la mer, l'air se raréfie avec l'altitude. La pression atmosphérique diminue avec l'altitude. La pression atmosphérique est plus grande au bord de la mer qu'au sommet d'une montagne. Au bord de la mer la colonne d’air qui est au-dessus de nous est plus haute: elle exerce donc sur nous une plus grande pression.

haute pression
basse pression
molécules d'air






Animation «états de la matière»


Animation «gaz»