Feux et flammes




Anatomie d’une flamme de bougie


Suite du cours: la combustion
Retour au portail des sciences



Retour au portail de chimie




Suite du cours: oxydation et réduction











Comment éteindre une flamme ?





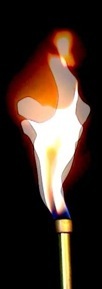
Qu'est-ce qu'une flamme?
Une flamme est la manifestation visible d'une réaction chimique de combustion. c’est le lieu de l’espace où des réactifs gazeux (combustibles et comburants) réagissent en produisant de la chaleur et de la lumière. Elle peut prendre diverses formes et couleurs.

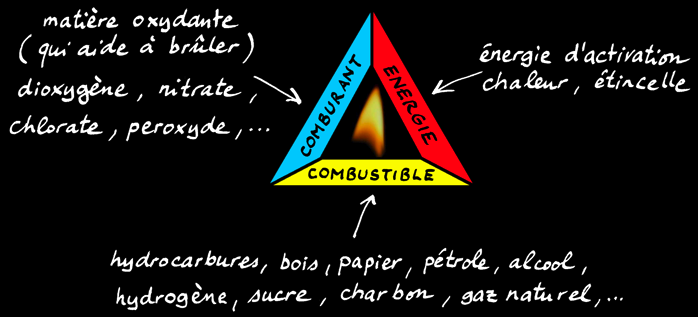
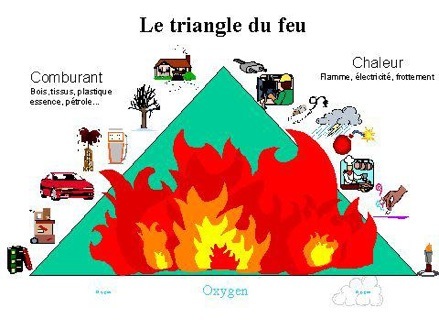
Le triangle de feu
Il faut réunir 3 conditions pour avoir une flamme:
Une substance combustible. C'est elle qui brûle en s'oxydant lors de la combustion.
Exemples: papier, bois, charbons (tourbe, lignite, houille, anthracite), hydrocarbures (pétrole, gaz naturel), substances organiques (graisses, protéines, sucres),...
Un comburant. C'est la substance qui aide à brûler en oxydant le combustible.
Exemples: oxygène (dioxygène), peroxydes (eau oxygénée), chlorates, nitrates, halogènes (chlore), ...
L'énergie. Elle sert à amorcer la réaction et à l'entretenir.
1.
2.
3.
X
X
X
Il faut éliminer l'un des côté du «triangle de feu» et empêcher la réaction entre le combustible et le comburant. Si on peut isoler (ou éliminer) l’un des deux réactifs, la réaction chimique n’a pas lieu.

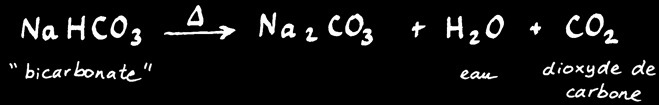
1.
On peut retirer ou éloigner le combustible du lieu de la réaction (fermer l'arrivée de gaz, ...)
Empêcher le comburant d'être en contact avec le combustible:
2.
en jetant sur le feu une couverture,
du sable, de la terre,...
en projetant un gaz inerte (CO2):
il ne réagit pas et prend la place de l'oxygène
•
•
La meilleure solution reste souvent d'absorber ou de retirer une partie de l'énergie produite par l'incendie:
3.

Les types de feux
en jetant de l'eau sur le feu. L'eau absorbe énormément de chaleur pour se transformer en vapeur.
en jetant de l'eau avec un additif (mousse).
•
•
Feux «secs» (classe A )
combustibles solides: bois, certains plastique, tissus,...
Feux «de liquides» (classe B)
combustibles liquides ou liquéfiables: hydrocarbures, pétrole, huile, graisse, vernis, alcool, solvants, polystyrène, polyéthylène,...
Feux «de gaz» (classe C)
hydrocarbures gazeux: méthane, propane, butane, gaz naturel, acétylène,...
Feux «de métaux» (classe D)
poudres de métaux: sodium, magnésium, aluminium... !! dégagement H2 avec l'eau.
•
•
•
•

Les extincteurs
à eau sur les "feux secs" (classe A )
à mousse (émulsion) sur les feux de classes A et B.
à poudre BC (bicarbonates + antiagglomérant + mica) sur les feux de classe A et B.
•
•
•
à poudre D. Elle est composée de carbonate ou de chlorure de sodium , de phosphate de calcium, de mica et parfois de poudre de cuivre pour dissiper la chaleur) sur les feux de classe D.
à poudre ABC . Elle peut contenir du phosphate ou du sulfate d'ammonium, du bicarbonate de sodium ...
•
•


Il y a une erreur dans ce joli dessin trouvé sur internet: trouve-la.

Exemple:
la combustion de la cire de bougie cesse dès qu’on empêche le comburant dioxygène de parvenir sur le lieu de la réaction.




La décomposition du bicarbonate par la chaleur produit du CO2 qui étouffe la flamme.


Fin de la page
On peut représenter cette réalité sous la forme d’un triangle:

2

Le combustible (cire, paraffine, stéarine) est à l’état solide.
La cire est chauffée: elle atteint sa température de fusion et forme un réservoir de combustible à l’état liquide.
Le combustible liquide monte par capillarité dans les fibres de la mèche.
La flamme bleue, c’est le lieu de la réaction chimique de combustion: le combustible passe à l’état gazeux et réagit avec le dioxygène de l’air. La température atteint 1200°C et la couleur bleue est due au phénomène de chimiluminescence.
Les produits de la réaction s’élèvent et se recombinent pour former de la suie.
La suie à haute température (1500°C) émet un rayonnement par incandescence («corps noir» à 1500°C) de cette lumière jaune si caractéristique de la bougie.
1.
2.
3.
4.
5.
6.



Anatomie d’une flamme de cuisinière au gaz
1
5
3
4
propane
dioxygène
dioxyde de carbone
eau
(oxyde d’hydrogène)
combustion
réaction de
les réactifs
les produits de la réaction
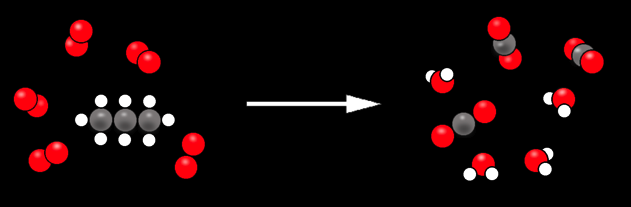
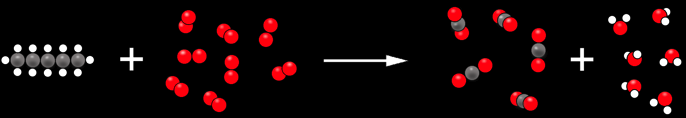
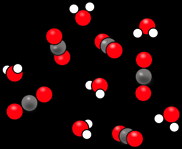
La production de lumière et de chaleur est due à la réaction chimique entre le gaz propane (un hydrocarbure) et le dioxygène contenu dans l’air.
Si nous regroupons les différentes substances en jeu, on obtient:
Nous pouvons simplifier ce dessin et vérifier qu’il y a autant d’atomes de chaque sorte au début et à la fin.
Nous pouvons aller encore plus loin et représenter les substances par des symboles.
1 C3H8 + 5 O2 ----> 3 CO2 + 4 H2O
La flamme bleue, c’est le lieu de la réaction chimique de la combustion d’un hydrocarbure (le propane).
La température atteint 1200°C et la couleur bleue est due au phénomène de chimiluminescence qui est produite par l’émission de photons bleus par des radicaux C2 et CH dans la flamme.

Quelques pointes de couleur jaune trahissent la présence de suie qui émet par incandescence.



Un hydrocarbure est une molécule formée d’atomes de carbone (symbole:C) et d’hydrogène (symbole: H). Certains hydrocarbures forment des chaînes simples de différentes longueurs.
Une molécule d’hydrocarbure est assez instable. Elle a tendance à réagir avec l’oxygène (réaction d’oxydation) en brûlant et en dégageant beaucoup de chaleur. On parle de réaction de combustion.
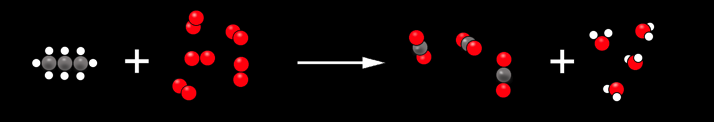
Etudions une réaction de combustion: celle du pentane (avec 5 atomes de carbone).
Avant = système initial
les réactifs
Après = système final
les produits
sens de la réaction
On peut aussi représenter cette réaction de manière plus claire en regroupant les molécules semblables:
Ou avec des symboles chimiques:

Combustion des hydrocarbures
D’autres des chaînes ramifiées. D’autres encore se referment sur eux-mêmes et forment des cycles. Tout est possible pour autant de respecter les règles du jeu: le carbone se lie 4 fois tandis que l’hydrogène n’a qu’une liaison.





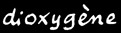














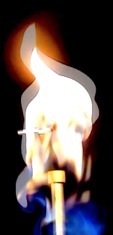







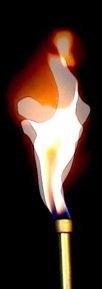



La flamme du bec Bunsen

Prémélange combustible / dioxygène
Lorsqu’on tourne la bague d’arrivée d’air, celui-ci se mélange au combustible avant de sortir du chalumeau: la réaction est complète, sans production de suie. La flamme se stabilise: elle éclaire moins mais chauffe davantage.
La danse du feu est dûe aux turbulences, aux mouvements chaotiques de l’air autour de la flamme.
Le gaz propane sorti de la bonbonne arrive en haut du chalumeau: c’est là qu’il entre en contact avec l’air (et le dioxygène). Le propane étant plus dense que l’air, il peut s’enflammer en entourant le chalumeau. La chaleur produite provoque une ascension des gaz: la flamme s’élève.
le propane est plus dense que l’air


La flamme du chalumeau oxyhydrique
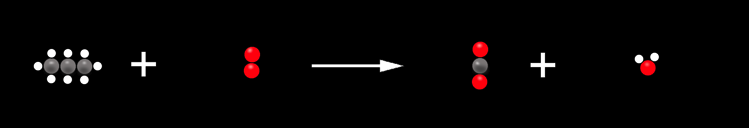
Mon chalumeau bricolé à partir d’un stylo à billes opère un mélange de gaz dihydrogène H2 et dioxygène O2. La réaction d’oxydation est très exothermique. On obtient une flamme de 2500°C. L’équation chimique s’écrit:










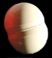
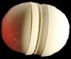

Système initial: les réactifs
Système final: les produits
Réaction
2 molécules de dihydrogène et
1 molécule de dioxygène
2 molécules de vapeur d’eau

Il faut mélanger les gaz dans un rapport stoechiométrique: 2 volumes de dihydrogène H2 pour 1 volume de dioxygène O2.


Flamme verte_Feu de bois

Flammes colorées
«Le feu face aux pompiers», un film de la série «C’est pas sorcier»

