Fabrication de plâtre
à partir d'un morceau de gypse
Fabrication de plâtre
à partir d'un morceau de gypse


Le plâtre est un liant hydraulique connu depuis l'Antiquité. Il est fabriqué à partir d'une roche blanche et tendre à l'aspect de sucre: le gypse, un sulfate de calcium hydraté (CaSO4 . 2 H2O). L'eau représente le 21 % de cette pierre et c'est par sa déshydratation partielle lors d'une cuisson qu'on obtient le plâtre. Le gâchage consiste à réhydrater la poudre de plâtre, ce qui entraîne une prise rapide (quelques minutes). La réaction de déshydratation du gypse s'écrit:
Le plâtre est un bon isolant thermique. Poreux, il absorbe et restitue très rapidement l'humidité de l'air mais se dégrade dans les endroits humides. Il oxyde les métaux ferreux ce qui nous oblige à galvaniser (recouvrir d'une couche de zinc) les armatures d'acier qui sont en contact avec lui. C'est un bon matériau de protection contre le feu du fait qu'il est capable d'absorber une grande quantité d'énergie calorifique pour opérer des transformations chimiques internes accompagnées de dégagement de vapeur d'eau (1)(2).
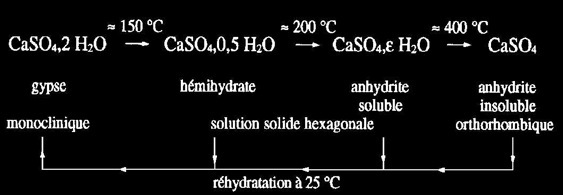
CaSO4 . 2 H2O CaSO4 . 0,5 H2O + 1,5 H2O
gypse (forme stable) plâtre (forme métastable)
Nous réussissons en un temps record la fabrication d'un plâtre de bonne facture qui nous permet de mouler divers objets.
Il est important de ne pas trop chauffer le gypse (150°C) sans quoi il se déshydrate complètement. Les réactions de déshydratation s'écrivent (1):
Nous brisons l'échantillon de gypse avec une massette et récupérons les morceaux aussi petits que possible dans un mortier. Nous le broyons à l'aide d'un pilon et d'un mortier jusqu'à l'obtention d'une poudre fine. Elle est ensuite versée dans un becher pour la cuisson (bec Bunsen). La température de cuisson doit s'élever à environ 150°C. Après avoir laissé refroidir le produit, nous le mélangeons à l'eau pour le gâchage puis le versons dans un moule où s'effectue la prise.
1 morceau de gypse
1 trépied
1 moule (ou gobelet en plastique)
1 massette
1 pilon
1 mortier
1 becher 400 ml
1 bec bunsen
de l'eau
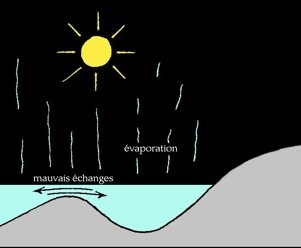
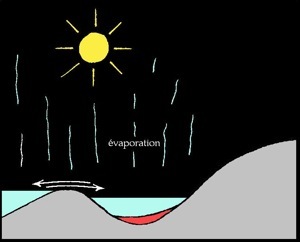
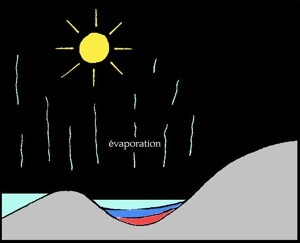
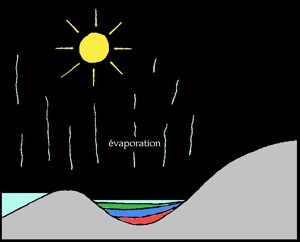
Fabriquer du plâtre à partir d'échantillons de gypse récoltés au Col de la Croix dans les Alpes vaudoises.



Coupe géologique passant par le Col de la Croix, le massif des Diablerets
et le Col d'Anzeinde (5)

Enfin lorsqu’il ne reste presque plus d’eau, les sels de magnésium et potassium se déposent. Lorsque l'on creuse dans de tels terrains qui n'ont pas été déformés et érodés on trouve successivement:
On peut représenter l'histoire de ces dépôts
78.0 %
18.0 %
3.6 %
0.4 %
NaCl, sel gemme (cuisine)
Sels de Mg et K
CaSO4, gypse et anhydrite
CaCO3, calcaire
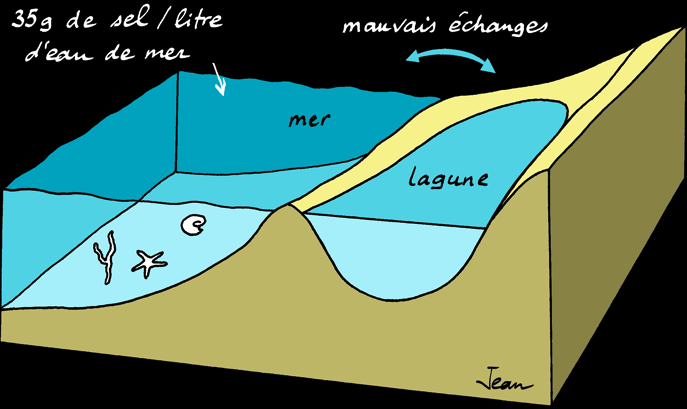
Le gypse fait partie de la famille des roches hydrochimiques ou évaporites qui se forment à partir de saumures ayant atteint leur point de saturation. Lorsque l'eau d'une lagune ou d'un marais salant s'évapore sous l'action du soleil, des sels peuvent précipiter (tomber au fond de l'eau). L'eau de mer contient 35 g/l de sels dissous, soit:
Caractéristiques des cristaux de la famille du gypse (3)
CaO
SO3
H2O
32,6 %
46,5 %
20,9 %







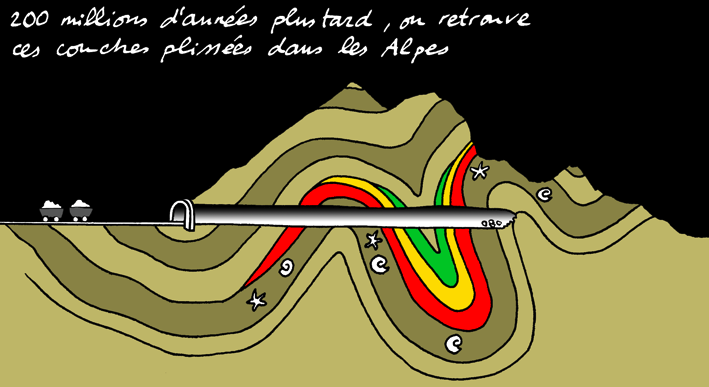
On ne retrouve pas facilement cette séquence de roches dans le profil géologique passant par le Col de la Croix à cause des déformations subies par les roches lors de la formation des Alpes.
1.
2.
3.
4.
Des sels de magnésium (Mg) et de potassium (K): on n'en trouve pas dans la région de Bex.
Du sel gemme (NaCl) qu'on trouve dans les mines de Bex (Lias des mines).
Du gypse qu'on trouve au Col de la Croix. Il s'est déposé au Trias au début de la subsidence alpine (phase de pré-rifting). C'est un dépôt de plateforme associé à la nappe de Bex (ultrahelvétique).
Du calcaire (Trias).
Le plâtre provoque l'oxydation des métaux ferreux. En effet, un jour après avoir coulé du plâtre dans un creuset en acier, celui-ci est déjà fortement rouillé. Toute armature ou fixation métallique en contact avec le plâtre dans une construction doit être galvanisée (recouverte d'une mince pellicule de zinc).
2.
R. Perrin, J.P. Scharff. Chimie industrielle vol. 2. Masson, Paris, 1993.
R. Wagner. Nouveau traité de chimie industrielle. Savy, Paris, 1873.
R. Dud'a, L. Rejl. La grande encyclopédie des minéraux, Gründ, Paris, 1986.
A. Foucault et J.-F. Raoult. Dictionnaire de géologie, Masson, Paris, 1992.
H. Badoux, H.-H. Gabus. Feuille 1285 Les Diablerets. Atlas géologique de la Suisse, Service hydrologique et géologique national, 2e ed, 1991.
1.
2.
3.
4.
5.
1.
Les pyramides de gypse du Col de la Croix (au premier plan)
et le massif des Diablerets (3000 m au fond).
Le gypse cristallise dans le système monoclinique. Il a une dureté de 1.5 à 2 sur l'échelle de Mohs. Sa densité varie entre 2.3 et 2.4 (3)
Composition centésimale du gypse: pourcentage des oxydes contenus dans la roche (3)
Il faut garder le plâtre à l'abri de l'humidité afin qu'il ne s'altère pas. Un emballage en plastique hermétique l'empêchera d'être en contact avec l'humidité atmosphérique.
Le Chatelier, dans sa thèse sur l'étude expérimentale de la constitution des mortiers hydrauliques, a donné de l'hydraulicité la théorie suivante (valable aussi pour le plâtre). Il y a, d'après lui deux phases dans le phénomène: la prise, qui se produit au bout de quelques minutes, et le durcissement qui vient à la suite et qui est beaucoup plus lent. La prise serait due à la cristallisation d'une solution sursaturée produite par l'hydratation du ciment: les hydrates formés précipiteraient brusquement. Le durcissement serait lié à la poursuite du phénomène de dissolution de l'hydrate amorphe et de recristallisation.
On remarque lors de la cuisson un changement de consistance de la poudre de plâtre: l'augmentation de la plasticité est due à la réorganisation des cristaux et à la déshydratation. Cette transformation est accompagnée d'un dégagement de vapeur d'eau qui se condense immédiatement sur les bords du becher. Cette condensation est le signe que la réaction recherchée se réalise.
3.
4.
5.


Buts de l'expérience
Matériel

Méthode

Résultats & conclusions

Remarques

Références

Introduction






gypse, monoclinique, stable.
plâtre, métastable (le plâtre a perdu 75 % de son eau).
anhydrite, orthorhombique.
anhydrite, polymorphe métastable, hexagonal
Le calcaire précipite quand il reste
20% d'eau
Le gypse précipite quand il reste 20-12% d'eau
Le sel gemme précipite quand il reste 10-5% d'eau
Mais dans une certaine proportion, le gypse anhydre CaSO4 a un rôle à jouer dans l'accélération de la prise.



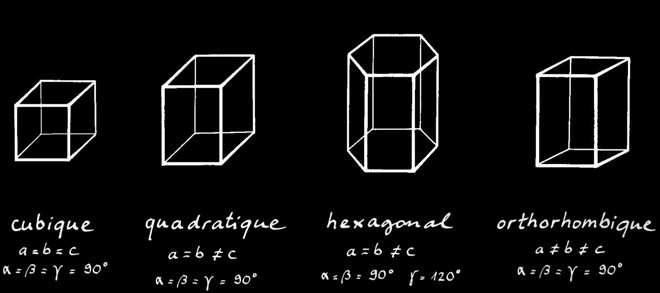
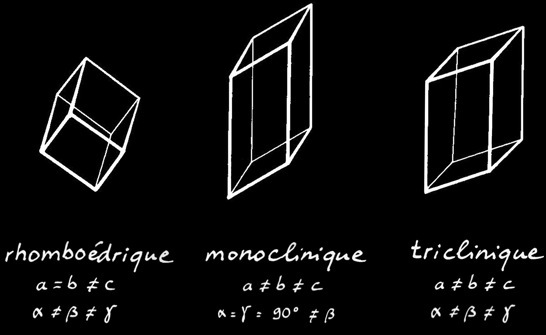
Les 7 systèmes cristallins


Formation du gypse
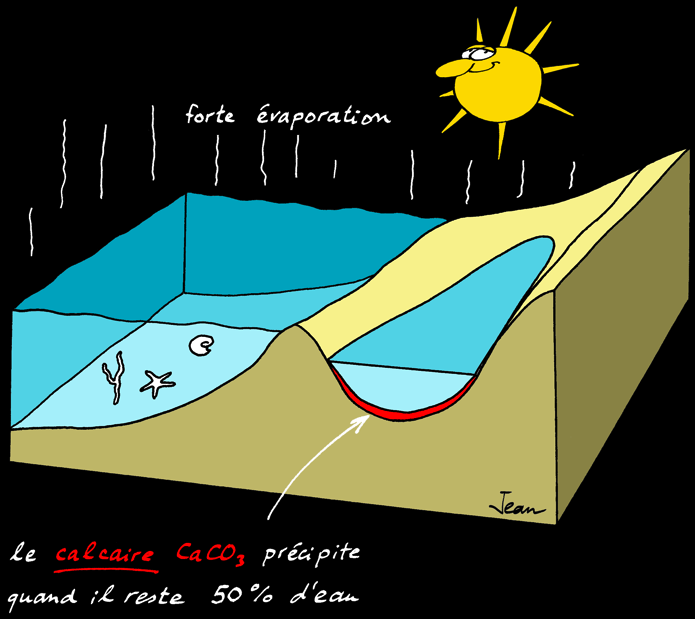
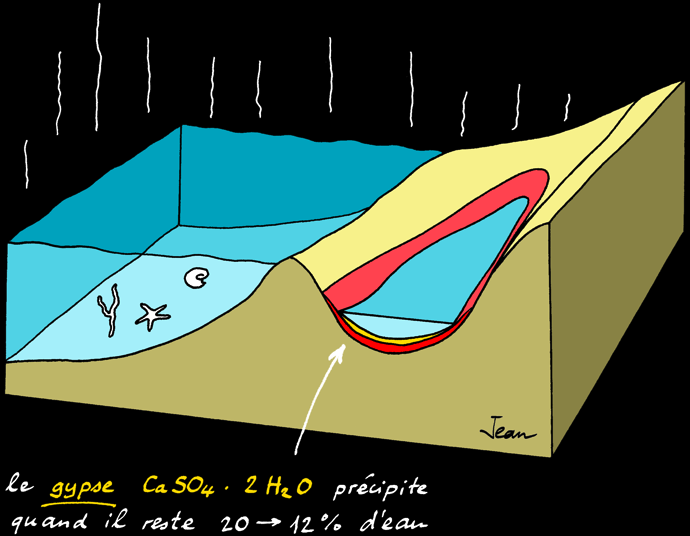
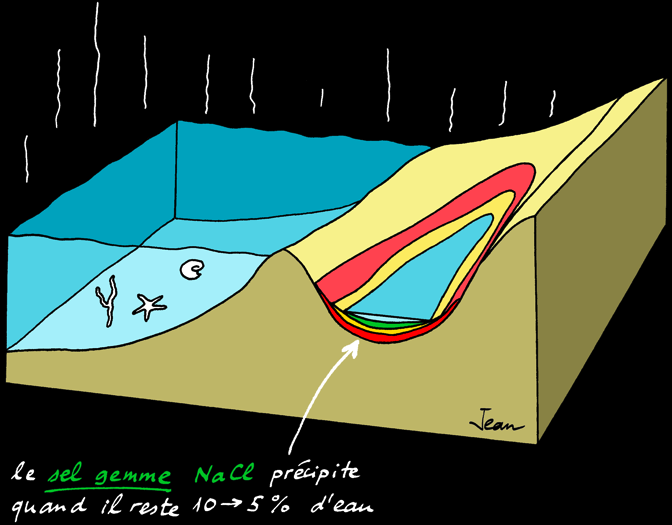
Au delà d'une certaine limite, les sels ne sont plus solubles et précipitent (ils tombent au fond) les uns après les autres. L'ordre dans lequel les sels précipitent s'appelle séquence évaporitique :
% d'évaporation
d'eau de mer
50 %
80 %
90 %
95 %
La salinité des océans est en moyenne de 35 g/l. Elle varie entre 30 g/l (Atlantique nord) et 40 g/l (mer Rouge). La mer Morte a une salinité supérieure (330 g/l) car c'est une mer fermée.
Anions
Chlorure
Sulfate
Hydrogénocarbonate
Bromure
Carbonate
Fluorure
Hydroxyde
Cations
Sodium
Magnésium
Calcium
Potassium
Les évaporites ou roches évaporitiques sont des roches sédimentaires salines. L'eau de mer contient environ 35 grammes de sels dissous par litre (35 g/l ou 3,5% de la masse). Lorsque l'eau s'évapore, il reste une saumure de plus en plus concentrée.
Sels
Calcite
Dolomite
Gypse
Halite
Sels de magnésium
Sels de potassium
Formule chimique
CaCO3
CaMg(CO3)2
CaSO4
NaCl
MgSO4
KCl
g/kg
19,3524
2,7123
0,1080
0,0673
0,0156
0,0013
0,0002
10,7837
1,2837
0,4121
0,3991
Formule
Cl-
SO4--
HCO3-
Br-
CO3--
F-
HO-
Na+
Mg2+
Ca2+
K+
mol/kg
0,54586
0,02824
0,00177
0,00084
0,00026
0,00007
0,00001
0,46907
0,05282
0,01028
0,01021
Composition moyenne de l’eau de mer


Fin de la page

Retour au portail de physique

Retour au portail des sciences



Retour au portail de géologie




Retour au portail de chimie







Visiter les roches sédimentaires

