Chimie de l’hydrogène


1. Explosion de l’hydrogène
Nous remplissons un ballon de baudruche d’hydrogène. Le gaz est très léger: il s’élève.
Lorsque nous approchons une allumette, le ballon explose avec un grand dégagement d’énergie sous forme de chaleur, de lumière (belle flamme orange), de bruit (explosion).
2. La vaisselle explosive
2 explosions très différentes se suivent:
Dans la première, les bulles de savon sont remplies de gaz hydrogène (H2) tandis que le dioxygène reste à l’extérieur du ballon: les réactifs sont donc séparés. La vitesse du front de la réaction (déflagration) est assez lente: on voit bien la flamme mais la détonation est faible.

L'hydrogène est un gaz di-atomique (chaque molécule de di-hydrogène H2 est composée de 2 atomes d'hydrogène H). C'est un excellent combustible: il donne beaucoup d'énergie quand il réagit avec le di-oxygène). On peut dégager toute l'énergie d'un coup (explosion) ou domestiquer cette réaction pour utiliser cette énergie (chalumeau, pile à combustible).
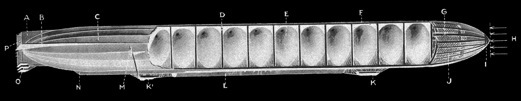

Le ballon dirigeable Zeppelin “Hindenburg” , d’une longueur de 247 mètres devait sa portance aux ballons remplis de gaz dihydrogène. Le 6 mai 1937, à l’atterrissage, il brûle en quelques secondes. La mise à la terre du ballon au moyen de câbles métalliques aurait causé une étincelle et l’inflammation du gaz.

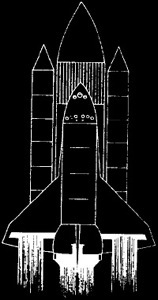
Le 28 janvier 1986, la navette spatiale “Challenger” se désintègre peu après le décollage avec 7 occupants à bord. 100 tonnes d’hydrogène liquide réagissent en quelques secondes.
Le gaz dihydrogène donne une voix de Mickey lorsqu'on remplit ses poumons avec.


Oxydation de l’hydrogène
Dans la seconde, les bulles de savon sont remplies d’un mélange de gaz dihydrogène (H2) et dioxygène (O2). Les réactifs étant intimement mêlés, la réaction est quasi instantanée. On n’a pas le temps de voir la flamme mais la détonation est plus forte.
L’équation chimique s’écrit:




Système initial: les réactifs
Système final: les produits
Réaction
2 molécules de dihydrogène et
1 molécule de dioxygène
2 molécules de vapeur d’eau



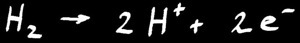
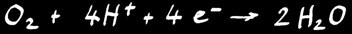









Cette page est en travaux. Bientôt la suite...



Suite du cours: la combustion
Retour au portail des sciences



Retour au portail de chimie




Suite du cours: oxydation et réduction









Fabrication d’un chalumeau oxyhydrique



