Déplacement d’équilibre




Lorsqu’un système chimique en équilibre est soumis à une contrainte, il réagit en déplaçant son équilibre dans le sens qui entraîne une diminution de cette contrainte.




Prenons la réaction de synthèse de l’ammoniac (équilibre de Haber & Bosch)
∆H , exprimé en kilojoules (kJ), signifie que de l’énergie est dégagée (∆H négatif) lorsque la réaction évolue de gauche à droite: on dit que la réaction est exothermique.
De droite à gauche, ∆H est positif: on doit fournir de l’énergie au système pour que la réaction ait lieu. La réaction est endothermique.
Nous allons étudier l’influence de la pression et de la température sur cet équilibre chimique, et la manière avec laquelle le système réagit face à cette contrainte.

Si l’on exerce une pression sur le système chimique, celui-ci va déplacer son équilibre dans le sens d’une diminution de cette pression (autrement dit: dans le sens de son volume propre le plus faible).
L’augmentation de pression déplace l’équilibre dans le sens
La diminution de pression déplace l’équilibre dans le sens



La réaction est exothermique (dégage de la chaleur) dans le sens
Elle est endothermique (absorbe de la chaleur) dans le sens
Pour s’opposer à la contrainte que représente une augmentation de température, le système déplace son équilibre dans le sens endothermique
Dans le cas d’une baisse de température, le système déplace son équilibre dans le sens exothermique





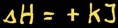






Influence de la pression

Influence de la température
Retour au portail des sciences



Retour au portail de chimie



Suite du cours: la liaison chimique



Suite du cours: les solutions aqueuses
Equilibrer l’équation et écrire la loi d'action de masse:
CO + O2 --> CO2
Equilibrer l’équation et écrire la loi d'action de masse:
C + CO2 --> CO
Equilibrer l’équation et écrire la loi d'action de masse:
HCl + O2 --> Cl2 + H2O ( ∆H = - kJ )
Déterminer les conditions de pression et de température qui favorisent la synthèse du chlore .
Equilibrer l’équation et écrire la loi d'action de masse:
Déterminer les conditions de pression et de température qui favorisent la synthèse de l'acide nitrique.
NO2 + O2 + H2O --> HNO3 ( ∆H = -kJ )
Dans 1 litre de solution , on introduit 1 mole de A et 1 mole de B . Après un certain temps, l'équilibre suivant est établi.
1 A + 1 B --> 1 C + 1 D
Quelles sont les concentrations de toutes les espèces chimiques après équilibre sachant que K = 4 ?


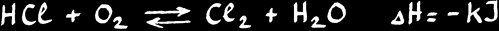



Exemple


Fin de la page






Henry Le Chatelier, 1884
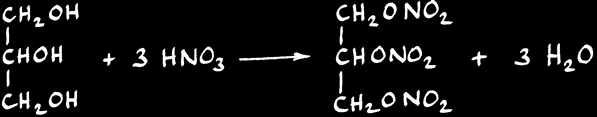
Glycérol ( = glycérine ) + 3 HNO3 --> nitroglycérine + 3 H2O
Un des intérêts de l'acide nitrique, est d'être à la base de la fabrication de la nitroglycérine selon la réaction suivante:

Historique de la synthèse de l’ammoniac
La synthèse de la nitroglycérine, dans le but de fabriquer des explosifs demandait de grandes quantités de salpêtre du Chili. En cas de crise, l'approvisionnement en nitrate de sodium pouvait poser des problèmes, vu l'éloignement des gisements.
On voit donc l'intérêt, pour les grandes puissances d'alors, de découvrir un autre moyen de synthétiser le HNO3. La puissante industrie chimique allemande, à la veille de la première guerre mondiale, trouva un moyen détourné de fabriquer l'acide nitrique.
Tout d'abord, en 1908, Fritz Haber réussit la synthèse de l'ammoniac à partir de l'azote atmosphérique selon la réaction que nous avons déjà rencontrée :
acide nitrique
Glycérol
( = glycérine )
nitroglycérine
eau
Nous avons vu que, pour déplacer l'équilibre de la réaction vers la droite, il fallait travailler à haute pression et basse température. Mais comme la vitesse de réaction est proportionnelle à la température, la synthèse se fit à très haute pression et température, en présence d'un catalyseur.


Avant la première guerre mondiale, l'acide nitrique (HNO3) était synthétisé à partir du salpêtre (étymologiquement: sel de pierre).
Salpêtre : KNO3
Salpêtre du Chili : NaNO3
Cette réaction se faisait à haute température et sous vide selon :
NaNO3 + H2SO4 --> NaHSO4 + HNO3




Lorsque les alliés déclenchèrent le blocus de l'Allemagne, la fabrication d'explosifs de celle-ci ne fut pas altérée: la production de HNO3 passa de 30 à 1000 tonnes par jour à la fin de la guerre.
Fritz Haber reçut le Prix Nobel de chimie en 1918 (décerné l'année suivante) pour sa «synthèse de l'ammoniac à partir de ses éléments».
A la même époque, Wilhelm Ostwald découvrit le moyen de synthétiser l'acide nitrique à partir de l'ammoniac selon une méthode catalytique.
Il était donc possible de synthétiser l'acide nitrique avec, à la base, uniquement de l'hydrogène et de l'azote.
Wilhelm Ostwald (1853-1932)
prix Nobel de chimie en 1909
La fabrication industrielle de l'ammoniac fut développée par Carl Bosch à la BASF (Badische Anilin und Soda Fabrik) dès 1913.
Lorsqu’on cherche à synthétiser une substance au moyen d’une réaction réversible, celle-ci mène à un équilibre et le rendement est limité. On peut alors déplacer l’équilibre pour favoriser un des sens de la réaction. Une loi simple permet de poser le problème.







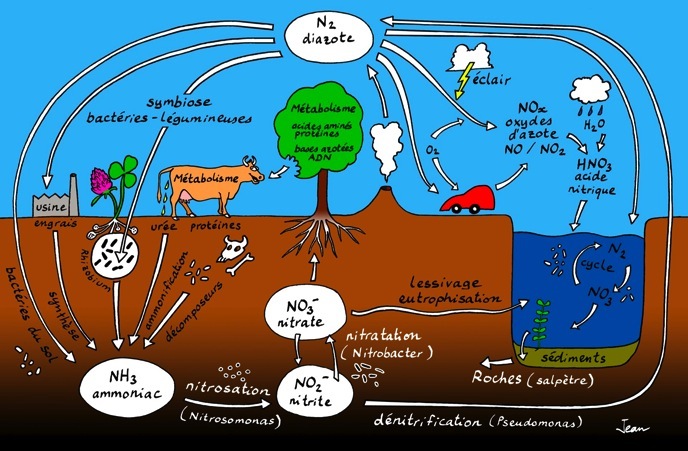
L’ammoniac dans le cycle de l’azote





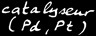


La synthèse de l'acide nitrique à partir de l'ammoniac se fait en plusieurs étapes. Une version simplifiée peut s’écrire en 3 équations:
1.
2.
3.