Mineraux





Les éléments
Les oxydes et hydroxydes
Les 7 systèmes cristallins
La minéralogie est la science qui s’intéresse aux minéraux. leur forme, leur composition chimique et leurs propriétés (chimiques et physiques). Elle s’intéresse aussi aux conditions de leur formation.
Les minéraux sont des substances chimiques que l’on trouve à l’état naturel le plus souvent sous la forme de solides cristallins ou cristaux.
On classe les minéraux selon leur composition chimique: les éléments, les sulfures, les halogénures (chlorures, fluorures...), les oxydes, les hydroxydes, les nitrates, les carbonates, les sulfates, chromates, phosphates, les silicates (les plus nombreux), les minéraux organiques,...


Ils ne sont formés que d’un seul type d’atomes qui ont tendance à résister à l’oxydation. On trouve parmi ceux-ci quelques métaux comme l’or, l’argent ou le cuivre.
Cuivre
Cuivre natif
Composition chimique théorique: Cu
Eclat: métallique
Densité: 8,9
Dureté: 2,5 à 3
Système cristallin cubique
Soufre
Soufre natif
Composition chimique théorique: S
Eclat: adamantin (cassure mate)
Densité: 2 à 2,1
Dureté: 1,5 à 2
Système cristallin orthorhombique
Fossa, Vulcano (Italie)
Tous les éléments chimiques sont classés dans la tableau périodique des éléments. Pour en savoir plus ...


Les sulfures

Les carbonates

Les silicates

Propriétés des minéraux
L’oxygène est l’élément chimique le plus représenté dans les minéraux et les roches. Son électronégativité élevée fait de ce “voleur d’électrons” l’oxydant le plus important. Il attire à lui 2 électrons et se trouve sous la forme


Quartz
Silice, dioxyde de silicium
Composition chimique théorique: SiO2
Variété “cristal de roche”, incolore et transparente.
Eclat: vitreux
Densité: 2,65
Dureté: 7
Système cristallin rhomboédrique
Massif du Saint-Gothard (Suisse)

L’élément silicium (Si) se trouve dans la 4e colonne du tableau périodique. Il a donc 4 électrons périphériques. Il réagit donc avec 2 atomes d’oxygène pour former SiO2
Améthyste
Quartz, silice: dioxyde de silicium SiO2
La coloration est due aux atomes de fer Fe3+,
titane et manganèse, présents en faible quantité.
Minas Gerais (Brésil)
Quartz fumé & granite
Quartz, dioxyde de silicium SiO2
Le granite en dessous contient des cristaux de quartz plus petits, associés à d’autres cristaux (feldspath et mica)
La coloration est due à la présence d’éléments radioactifs à l’état de traces
(très faible quantité)
Quartz rose
Silice, dioxyde de silicium
Composition chimique théorique: SiO2
Variété rose translucide
Cassure conchoïdale (comme le verre)
Eclat: vitreux
Densité: 2,65
Dureté: 7
Système cristallin rhomboédrique


Glace
Eau, monoxyde de dihydrogène
Composition chimique théorique: H2O
Système cristallin hexagonal

Le soufre se trouve comme l’oxygène dans la 6e colonne du tableau périodique. Son électronégativité est cependant moins élevée. Il attire aussi à lui 2 électrons et se trouve sous la forme

Galène
Sulfure de plomb PbS dans une gangue de fluorine CaF2
Composition chimique théorique: PbS
Eclat: métallique
Densité: 7,2 à 7,6
Dureté: 2,5 à 3
Système cristallin cubique
Mine des Trappistes, Valais (Suisse)
Pyrite & magnétite
Disulfure et oxyde de fer
Pyrite, éclat doré FeS2
magnétite aiguilles grises Fe3O4

Dans le cas du disulfure de fer (pyrite), le soufre est au degré d’oxydation -1
Il forme un pont disulfure :
On peut le noter


Ici le fer (Fe) est oxydé à la fois par l’oxygène et le soufre. Il y a donc une compétition pour la formation d’oxyde de fer et de sulfure de fer. Avec le temps, les échantillons de sulfures ont tendance à s’oxyder (voir la marcassite ci-dessous). Le soufre, délogé, se retrouve à l’état élémentaire jaune.

Nodule de Marcassite
Sulfure de fer FeS2
Concrétion fibro-radiée
Cet échantillon est fortement altéré
En brun, des oxydes et hydroxydes de fer (limonite)
En jaune, le soufre
Système cristallin orthorhombique

Chalcopyrite
Sulfure de cuivre et fer
Composition chimique théorique: CuFeS2
Eclat: métallique
Couleur: laiton avec irisations
Densité: 4,2 à 4,3
Dureté: 3,5 à 4
Système cristallin quadratique
Calcite
Carbonate de calcium
Composition chimique théorique: CaCO 3
Eclat: vitreux
Densité: 2,6 à 2,8
Dureté: 3
Système cristallin rhomboédrique
Les plans de clivage sont bien visibles(Mexique)


Calcite
Carbonate de calcium
Exemplaire poli
(Chine)
Le cristal de calcite a une propriété remarquable: la biréfringence. Les rayons lumineux sont doublement réfractés: on “voit double” à travers le cristal.


Malachite
Carbonate et hydroxyde de cuivre
CuCO3 . Cu(OH)2
Minerai de cuivre (Congo)

Malachite (vert)
Carbonate et hydroxyde de cuivre
CuCO3 . Cu(OH)2
Azurite (bleu)
Carbonate et hydroxyde de cuivre
CuCO3 . Cu(OH)2

Muscovite
Phyllosilicate, mica blanc alumineux
Composition chimique théorique: KAl2 [Si3AlO10 (OH,F)2 ]
Eclat: nacré, vitreux, soyeux
Densité: 2,7 à 2,8
Dureté: 2 à 2,5
Système cristallin monoclinique
Les minéraux sont des substances chimiques que l’on trouve à l’état naturel le plus souvent sous la forme de solides cristallins ou cristaux.
Il existe quelques critères utiles pour décrire et caractériser les milliers de minéraux:
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13
La forme des cristaux (dérivés des 7 systèmes cristallins)
La densité
La dureté
La couleur
Le goût (sel)
La trace (couleur du minéral en poudre)
L’éclat (métallique, vitreux, nacré, mat,...)
Le clivage (propriété de se casser selon des directions déterminées)
La transparence
La solubilité dans différentes substances
La luminescence
Les propriétés électriques (conductibilité) et magnétiques
La radioactivité
En chantier... Bientôt la suite




















Fin de la page
Retour au portail de physique

Retour au portail des sciences



Retour au portail de géologie




Retour au portail de chimie







Visiter les roches sédimentaires

Visiter les roches magmatiques




Visiter les roches métamorphiques












Cristallographie










Phyllosilicate:
les tétraèdres de silicate sont disposés en feuillets

C’est la famille minérale la plus importante: ils constituent plus de 90 % de la masse de la lithosphère.
L’anion silicate SiO4 -- forme un tétraèdre (une pyramide à base triangulaire). Les atomes d’oxygène occupent les sommets de la pyramide centrée sur l’atome de silicium.

O--
Si4+
atome d’oxygène
atome de silicium



Le tétraèdre est la figure géométrique à la base de la construction de tous les silicates.
Représentation vu de dessus

Les nésosilicates
Les tétraèdres n’ont pas de sommet commun
Exemples: olivines, grenats,...
Les sorosilicates
Les tétraèdres ont un sommet commun
Exemples: épidotes,...
Les cyclosilicates
Les tétraèdres ont 2 sommets en commun.
Ils forment des anneaux.
Exemples: béryl, tourmaline,...
Les inosilicates “pyroxènes”
Les tétraèdres ont 2 sommets en commun.
Ils forment des chaînes simples.
Exemples: pyroxènes
Les inosilicates “amphiboles”
Les tétraèdres forment des chaînes doubles.
Exemples: amphiboles
Les phyllosilicates
Les tétraèdres forment des feuillets: minéraux en 2D.
Exemples: mica, talc, chlorite, serpentine,...


l’atome de silicium est “caché” à l’intérieur
Il y a plusieurs sortes de silicates:
Les tectosilicates
Les tétraèdres partagent tous leurs sommets.
Exemples: quartz, feldspaths,...
oxygène
silicium



Quartz
Tectosilicate, silice, dioxyde de silicium
Composition chimique théorique: SiO2
Variété “cristal de roche”, incolore et transparente
Eclat: vitreux
Densité: 2,65
Dureté: 7
Système cristallin rhomboédrique
Massif du Saint-Gothard (Suisse)
La cristallographie est la science qui étudie les cristaux. Comme la minéralogie, elle s’intéresse à la composition chimique des espèces minérales mais surtout à l’arrangement spatial des atomes.
Les atomes sont des petites boules qui occupent l’espace. Ils peuvent se ranger de différentes manières.
Les oranges sont faciles à ranger. Mais différentes solutions se présentent déjà...
Il reste de la place pour un “atome” plus petit comme un kiwi

Il y a tout juste la place pour glisser une noix...

L’ atome A est entouré de 4 atomes
L’ atome B est entouré de 6 atomes
A
B
La situation se complique quand on rajoute une couche: les cristaux sont des constructions en 3 dimensions.
Espace disponible

Le problème avec les atomes, c’est qu’ils n’ont pas la même taille. Et en plus ils portent des charges électriques différentes.


l’oxygène est un gros ion négatif

le calcium et le sodium ont la même taille... mais pas la même charge positive


le silicium est un ion positif très petit

Dans la croûte terrestre, on trouve 60% d’atomes d’oxygène, 20% d’atomes de silicium. C’est donc ces 2 atomes qui forment la structure de base des principales roches.




Anorthite_labradorite

Aragonite (CaCO3_monoclinique)

Borax (borate)

Fluorite CaF2

Goethite

Goniomètre

Hematite

Lazurite

Opale (SiO2 . n H2O)

Or (Au) natif
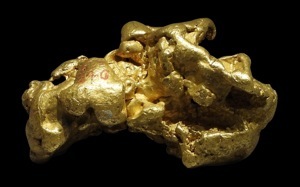
Or (Au) pépite
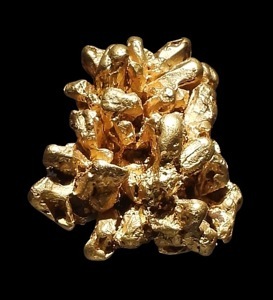
Or (Au) pepite

Or et quartz (buisson d’or)

Platine (Pt) natif

Pyromorphite

Rhodochrosite

Soufre natif (S8)

Stibnite

Belemnite_rostre_opale

Papilion de Montrouzier
(Papilio montrouzieri)