Plongée et loi des gaz

PpN2 + PpO2 + PpAr+ PpCO2 + ... = Ptot = 1 atm ~ 1 bar ~ 1000 hPa (approximation)
Retour au portail de chimie





Fin de la page
Retour au portail de physique

Retour au portail des sciences



Retour au portail du corps humain










Le dioxygène représente 21 % du mélange "air". Il participe donc pour 21 % à la pression atmosphérique, soit environ 0,21 bar
Les variations de pression ont très peu d'effets sur les solides et les liquides. Les gaz par contre, sont très sensibles aux variations de pression.
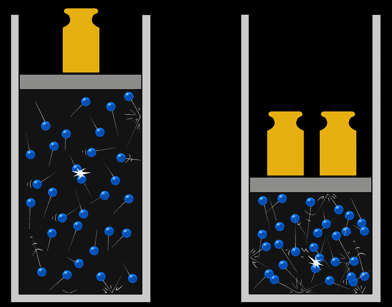
Lorsque nous enfermons un gaz dans un récipient (ballon), la matière ne peut ni entrer ni sortir. La quantité de gaz dans le ballon est constante: c'est un système isolé. On peut simplifier la loi des gaz:
Ce qui veut dire que toute augmentation de pression (P) doit amener une diminution de volume (V) ou/et une augmentation de température (T).
La loi des gaz parfaits relie différentes grandeurs physiques dans une simple équation:



Si on prend la colonne d’air qui presse sur ma tête au bord de la mer (altitude = 0m) on peut dire qu’elle exerce une pression de 1 atmosphère (1 atm). Cette colonne formée de milliers de mètres d’air exerce la même pression qu’une colonne de mercure de 76 centimètres (ou 760 mm Hg). Comme toujours, il existe plusieurs unités de mesure qui ont leur utilité dans certaines occasions. On peut les convertir assez facilement:
1 atm = 760 mm Hg = 760 torr = 1,013 bar = 1013 mbar (millibar) = 1013 hectopascals (hPa)
La pression atmosphérique se mesure avec un baromètre. Elle a été longtemps mesurée en mmHg en raison de l'utilisation du baromètre à colonne de mercure. Masse volumique du mercure (symbole chimique: Hg pour Hydrargyrum) = 13,55 g·cm-3 (20 °C).
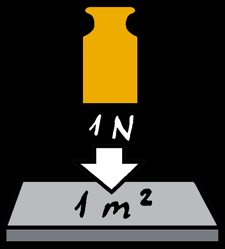
Actuellement le pascal est l’unité internationale de pression. Il correspond à une force de 1 newton exercée perpendiculairement à une surface plane de 1 mètre carré.
On note:

Accidents de plongée

La pression double
le volume est divisé par 2
... le produit PV reste constant
L’homme s’est adapté à des conditions de vie terrestre. Il supporte certaines variations de température et de pression. Les conditions de vie sous l’eau sont bien différentes. Il faut se souvenir que la pression exercée par l’eau à 10 mètres de profondeur est le double de celle subie au bord de la mer. Les effets sur le corps sont multiples et parfois mortels.

Les barotraumatismes
Un barotraumatisme est causé par une variation de pression d’un gaz emprisonné dans le corps. Tout le monde a déjà ressenti un barotraumatisme de l'oreille moyenne lors d'un voyage en avion ou à la montagne. La variation des pressions est décrite par la loi de Boyle-Mariotte.
À la surface de l'eau, la pression est dite "atmosphérique": elle vaut 1 [atmosphère] soit environ 1 [bar].
À 10 mètres de profondeur, la pression vaut le double: 2 bar.
Un ballon rempli avec 1 litre d'air est descendu à 10 mètres de profondeur: son volume est divisé par deux. Une fois remonté à la surface, il retrouve son son volume d’origine.
Si un plongeur inspire 1 litre de gaz à la profondeur de 10 mètres et qu’il remonte en retenant sa respiration, le volume aura doublé et occupera 2 litres.
Les effets de la pression sur un plongeur:
•
•
•
•
•
Les oreilles. Un déséquilibre entre la pression extérieure et la pression de l'oreille interne déforme le tympan à cause de l'obstruction de la trompe d'Eustache. La Manœuvre de Valsalva permet d'équilibrer la pression de chaque côté du tympan. Antonio Valsalva (1666-1723, Médecin à Bologne ). Lorsqu'une seule des deux trompes d'Eustache est bouchée, la différence d'informations transmises au cerveau par les organes de l'équilibre peut provoquer un vertige et une désorientation.
Les poumons. Lors d'une remontée précipitée (en catastrophe), les poumons vont se dilater: c'est la «surpression pulmonaire». Les alvéoles pulmonaires peuvent se déchirer, les échanges gazeux sont perturbés. Du sang peut entrer dans le circuit ventilatoire et des bulles d'air peuvent entrer dans la circulation sanguine: risque d'embolie gazeuse. Cet accident peut survenir près de la surface. Lors d'une remontée de 5 mètres (1,5 bar) à la surface (1bar) le volume d'air contenu dans nos poumons augmente de 50 % . Il ne faut donc jamais bloquer sa respiration en remontant.
Les yeux. Lors de la descente du plongeur, la pression augmente et le volume d’air à intérieur du masque diminue. La bordure souple du masque se déforme jusqu'à un certain point. Ensuite, la dépression créée dans l'espace restant peut provoquer un éclatement des capillaires sanguins (effet de ventouse) dans les yeux (injectés de sang) et les paupières (hématome style «œil au beurre noir»).
Les dents . En cas de fissure, de carie ou d'amalgame mal réalisé.
Le système digestif. Des gaz sont emprisonnés ou produits dans les cavités (estomac ou intestins).

Loi de Boyle et Mariotte
Dans un être vivant homéotherme (="à sang chaud") comme nous, la température du corps reste à peu près constante. Elle varie chez l'être humain autour de 37 °C.
Une poche d'air emprisonnée momentanément dans le corps humain (dans les poumons ou les intestins) peut être décrite par une version plus simple de la loi des gaz. C'est la loi de Boyle et Mariotte: elle n’est valable que si la température reste constante (condition isotherme).
«Dans des conditions isothermes (= à température constante"), le produit de la pression par le volume d'un gaz est constant».
On peut écrire:

Loi de Henry
Le plongeur doit descendre lentement pour réaliser à chaque instant un équilibre entre la pression extérieure et la pression des divers compartiments du corps. Si ce n’est pas possible (sinus bouché par exemple), il faut stopper la descente.
Lors de la remontée, il faut veiller à vider de manière continue les cavités en question afin d'éviter tout risque de gonflement, voire d'explosion.
•
•
Comment éviter les accidents?
L'atmosphère terrestre est un mélange de gaz de composition assez stable. Seule la quantité d'humidité (vapeur d'eau) peut varier notablement. La composition de l'air sec est (en % du volume):
... et quelques gaz rares



Autre gaz

diazote
dioxygène
argon0,9 %
dioxyde de carbone0,04 %
78 %
21 %
1 %
Chaque gaz participe à la pression atmosphérique en fonction de son pourcentage:
On définit la pression partielle (Pp) d'un gaz dans un mélange de gaz comme la contribution de ce gaz à la pression totale du mélange. La somme des pressions partielles de chaque constituant du mélange donne la pression totale du mélange gazeux.
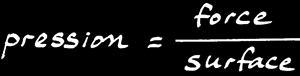
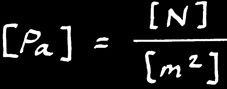
Avec les unités:

dioxygène 14%
hélium 58%


... diazote 100 - (14+58) = 28%
Profondeur max: 90m

Il faut revenir lentement à la pression normale en faisant des arrêts: des paliers de décompression.
Pour des plongées très profondes, on utilise des mélanges gazeux qui contiennent moins de dioxygène. Par exemple:
Le trimix est un mélange composé de dioxygène (O2), d'hélium (He) et de diazote (N2).
L'héliox est un mélange de dioxygène (O2), d'hélium (He)
Utilisation d'un caisson hyperbare (ou caisson de décompression) en cas d'urgence (remontée en catastrophe d'un plongeur).
Une étiquette sur la bouteille affiche la profondeur maximale d'utilisation et le mélange.
•
•
•
Comment éviter un accident de décompression?
Dans le Génie civil, des caissons sous pression pour éviter les infiltrations d’eau lors de travaux souterrains (tunnels, mines, fondations) ont tué beaucoup d'ouvriers au 19e siècle (15 morts sur le chantier du pont de Brooklyn) avant qu'on comprenne la cause de cette mystérieuse "maladie des caissons". Une ascension rapide dans un avion non pressurisé peut produire aussi cet effet.
•
•
L'ivresse des profondeurs: le diazote N2 diffuse dans les membranes des cellules nerveuses et perturbe le fonctionnement du système nerveux: il a un effet narcotique et provoque des troubles du comportement (euphorie, angoisse, discours intérieur,...).
L’accident de décompression qui survient lorqu'on revient trop rapidement d'un environnement à pression élevée. Le diazote N2 inspiré passe normalement dans le sang. Il se dissout ensuite dans les tissus (il est très soluble dans les graisses). Lors d'un retour trop rapide à la pression atmosphérique, le gaz retourne dans le sang en formant des bulles. Celles-ci sont entrainées dans la circulation sanguine est vont obstruer des petits capillaires sanguins: c'est l'embolie gazeuse qui peut toucher le cerveau, les poumons, les reins, le coeur,...
Accidents de plongée: l'hyperoxie
L'hyperoxie est due à un excès d'apport en dioxygène. Le dioxygène indispensable à notre vie, est très nocif à haute dose pour nos cellules: inflammation et brûlure des poumons (effet Paul Bert), altération des cellules nerveuses (effet Lorrain Smith). Notre organisme est adapté pour vivre avec une pression partielle d'oxygène de 210 hPa (ou 0,21 bar). Des variations de 170 à 500 hPa ne posent pas de problème. Lorsque la pression partielle inspirée dépasse 500 hPa, on parle d'hyperoxie. Le corps humain peut supporter pendant de courtes durées des pressions plus élevées. Les fédérations de plongée ont fixé un seuil admissible de pression partielle d'oxygène (PpO2) compris entre 1400 hPa (1,4 bar) et 1600 hPa (1,6 bar).
1,4 bar de PpO2 correspond à une profondeur de 57 mètres pour une plongée avec des bonbonnes d'air (1,4 bar / 21 % d'O2 = 6,7 bar de pression totale. 1 bar de pression atmosphérique + 5,7 bar de pression hydrostatique) et à 4 mètres pour une plongée avec des bonbonnes d'oxygène pur. Pour des plongées très profondes, on utilise des mélanges gazeux qui contiennent moins de dioxygène.
Accident de décompression
Le gaz diazote est inerte et inoffensif à la pression atmosphérique mais il pose 2 problèmes graves lors d'une plongée:
ouverture d'une boisson "gazeuse".
dissolution des gaz dans le corps d'un plongeur: en plongée, la pression augmente d'une atmosphère tous les 10 mètres.
Exemples:
•
•
La Loi de Henry, formulée en 1803 par William Henry, énonce :
«À température constante et à l'équilibre, la quantité de gaz dissous dans un liquide est proportionnelle à la pression partielle qu'exerce ce gaz sur le liquide».
La concentration maximale d'un gaz en solution, en équilibre avec une atmosphère contenant ce gaz, est proportionnelle à la pression partielle exercée par ce gaz.
On note:
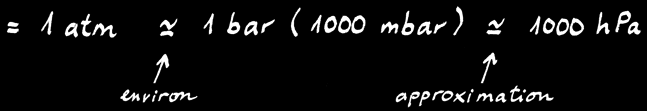
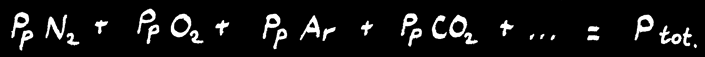

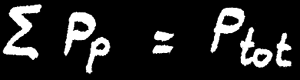


la lettre grecque “sigma” signifie: «somme de...»