La réaction chimique


Le mécanisme réactionnel fait appel à la formation de radicaux:
et
Un radical est un atome ou une molécule qui possède un électron célibataire (représenté par le point).
Il peut être formé, par exemple, sous l’action de la lumière.
Les radicaux sont très instables donc très réactifs: leur durée de vie est très courte. Ils tendent à reformer immédiatement un composé stable.



Système initial: les réactifs
Système final: les produits
Réaction
1 molécule de dichlore et
1 molécule de dihydrogène
2 molécules
de chlorure d’hydrogène




Une réaction chimique est une modification de l’assemblage des atomes. Il y a rupture des liaisons chimiques des réactifs et formation de nouvelles liaisons pour former les produits de la réaction. On peut la symboliser par une équation chimique:
Les substances A et B réagissent pour former les produits de la réaction C et D.
La flèche symbolise le sens de la réaction.
réactifs
produits
Cette équation ne dit rien sur:
Les quantités de réactifs et de produits
L’état des réactifs et des produits (solide, liquide, gaz)
La vitesse de réaction (lente, rapide, explosive...)
L’aspect énergétique (absorption ou dégagement de chaleur)
Les conditions de pression et de température qui influencent la réaction
le mécanisme réactionnel (compréhension “au ralenti” des phases de la réaction)
1.
2.
3.
4.
5.
6.
L’équation n’est qu’un bilan de la réaction. Elle donne des renseignements sur l’état initial (réactifs) et sur l’état final (produits) du système, mais en aucun cas sur l’évolution de celui-ci durant la réaction.



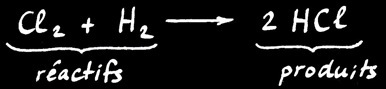
Le dichlore Cl2 et le dihydrogène H2 réagissent pour former le chlorure d’hydrogène HCl(appelé aussi acide chlorhydrique).
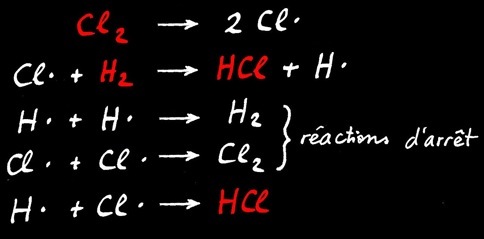



Etat initial
Etat final
Si on étudie le mécanisme réactionnel, 5 réactions sont en compétition: le bilan (en rouge) est représenté par l’équation chimique.
bilan
Bilan simplifié
Mécanisme réactionnel
Remarques:


Quand on mélange de la poudre de fer et de soufre, et qu'on chauffe, le soufre commence à fondre à 119°C. La température continue de monter et la réaction démarre: on peut retirer l’éprouvette de la flamme, les réactifs deviennent incandescents. Il se produit la synthèse du sulfure de fer (FeS) selon l'équation :
Nous fabriquons une bombe puante à base de soufre et de fer en poudre. Dans la recette, nous pouvons distinguer 2 réactions chimiques différentes. La description des réactions se trouve un peu plus bas.



H
H
H
H
Cl
Cl
Cl
Cl
On peut écrire la réaction chimique sous la forme d’une équation:

Un exemple simple pour commencer


On récupère le sulfure de fer et on le réduit en poudre. On le met au fond d’une éprouvette et on rajoute une solution d’acide chlorhydrique HCl 1M (attention les yeux!). Le dégagement de gaz sent l’oeuf pourri: c’est le gaz sulfure d’hydrogène. L’équation s’écrit:

Retour au portail des sciences



Retour au portail de chimie





Suite du cours: équation chimique



Introduction

Définition





Fin de la page

Vitesse d’une réaction chimique



La réaction chimique est-elle plus rapide dans l'eau chaude ou dans l'eau froide?
Ai-je déjà essayé de dissoudre du sucre dans un liquide chaud ou froid?
Pourquoi garde-t-on de la nourriture dans un réfrigérateur ?
Comment peut-on se représenter ce qui se passe lorsqu'un liquide et un solide réagissent en produisant un gaz? Comment expliquer l'importante augmentation de volume?
La chimie étudie la matière et ses transformations.
Aujourd'hui nous allons réaliser 2 expériences de chimie à la cuisine.
Nous avons besoin de 3 comprimés effervescents.
Expérience 1: l'effervescence produit un gaz.
•
•
•
•
•
Je place un comprimé effervescent SOLIDE au fond d'une bouteille.
Je rajoute un peu d'eau LIQUIDE.
Je bouche rapidement le goulot avec un ballon.
J'observe le dégagement de bulles de GAZ.
J'observe le redressement du ballon.
Je me pose des questions:
1.
2.
3.
4.
5.
6.
7.
Pourquoi le ballon se redresse-t-il?
Qui a soufflé dans le ballon?
Qu'y a-t-il dans les bulles?
Quelles sont les propriétés des solides, des liquides et des gaz?
Qu'est devenu le comprimé?
Est-ce qu'il y a plus d'eau dans la bouteille à la fin de l'expérience?
Est-ce qu'il y a plus de gaz à la fin de l'expérience?
Expérience 2: la vitesse de réaction dépend de la température.
•
•

Je me pose des questions:
1.
2.
3.
4.










