Réactions d’oxydo-réduction

Dissociation électrolytique du sulfate de cuivre en solution aqueuse:
les ions Cu++ et SO4-- sont libérés.
Immersion de la feuille d’aluminium: mise en présence du Cu++ et de Al. La réaction d’oxydo-réduction se produit selon l’équation:
Deux réactions se produisent parallèlement:
La réduction du cation Cu++ en cuivre métallique, qui précipite au fond du récipient.
L’oxydation de l’aluminium en ion Al+++. L’ion est dissous dans l’eau ce qui explique l’apparition des trous dans la feuille.
Et le fluorure d’oxygène (le fluor est l’élément le plus électronégatif)
Sauf dans les hydrures, où il est lié à un élément moins électronégatif que lui: il se trouve alors au degré d’oxydation -1.
(hydrure de sodium)

Sauf dans les peroxydes (peroxyde de sodium)
(peroxyde d’hydrogène = eau oxygénée)













1. Oxydation et combustion
Nous avons déjà vu des réactions d’oxydation et de combustion: certaines substances réagissent plus ou moins bien avec le gaz dioxygène contenu dans l’air. La réaction s’accompagne souvent d’un grand dégagement d’énergie sous forme de chaleur et de lumière.

2. Oxydation sans oxygène
Le cuivre peut s’oxyder en réagissant avec le dioxygène O2 pour former un oxyde de cuivre. Il peut aussi s’oxyder sans oxygène en réagissant avec l’acide nitrique. La réaction suivante est violente et le dégagement de chaleur intense.
Pour comprendre cette réaction, il faut redéfinir la notion d’oxydation et l’intégrer dans un champ plus vaste: celui des réactions d’oxydo-réduction.
Nous avons 3 types de liaisons chimiques:
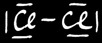
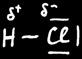
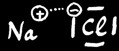
Liaison ionique
Liaison covalente
Liaison covalente à caractère ionique partiel
NaCl
Cl2
HCl
On appelle degré d’oxydation, ou nombre d’oxydation d’un élément, la charge positive ou négative, entière ou partielle, portée par cet élément dans le corps auquel il appartient.
Dans NaCl
Le Na porte une charge + ....
Le Cl porte une charge - ....
On note
Il est au degré d’oxydation +1
Il est au degré d’oxydation -1

Dans Cl2
Le Cl ne porte aucune charge ....
On note
Il est au degré d’oxydation 0
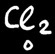
Dans HCl
Le H porte une charge partielle + ....
Le Cl porte une charge partielle - ....
On note
Il est au degré d’oxydation +1
Il est au degré d’oxydation -1
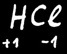
Nous pouvons déterminer les degrés d’oxydation des éléments d’une molécule grâce à leur valeur d’électronégativité. Prenons l’exemple de l’acide perchlorique HClO4.
Notons les éléments de HClO4 dans la notation de Lewis:

Détermination des degrés d’oxydation
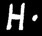
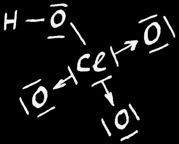
Ecrivons la formule développée:
Les valeurs d’électronégativité
H
Cl
O
2,1
3,0
3,5
On déduit de ces valeurs le nombre de charges partielles portées par chaque élément:
H a tendance à céder son électron à O : il est au degré d’oxydation +1
O attire deux électrons : il est au degré d’oxydation -2
Cl a tendance à céder tous ses électrons à O : il est au degré d’oxydation +7
A partir de là, il est possible de simplifier le problème, en retenant quelques règles simples, qui permettent pour autant qu’on les applique dans l’ordre, de trouver les degrés d’oxydation.
1.
2.
3.
4.
5.

Règles pour déterminer les degrés d’oxydation
Dans un corps composé de plusieurs éléments, la somme algébrique des degrés d’oxydation est toujours égale à 0 ou à la charge du ion si c’en est un.
Exemple : 2(+1)+2(+6)+7(-2)=0
Dans un corps à l’état élémentaire, l’élément est toujours au degré d’oxydation 0
Les métaux alcalins (1e colonne) sont toujours au degré d’oxydation +1.
Les métaux alcalino-terreux (2e colonne) sont toujours au degré d’oxydation +2.
L’hydrogène est toujours au degré d’oxydation +1


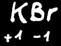

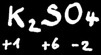
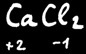

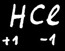
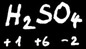
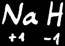
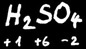
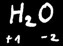
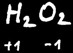
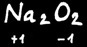

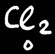

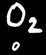
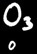
Les réactions au cours desquelles des éléments changent de degré d’oxydation sont appelées réactions d’oxydo-réduction.
Exemple : la combustion de l’aluminium donne l’alumine.

Réactions d’oxydo-réduction
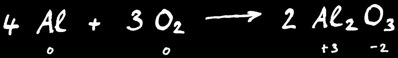
Au cours de cette réaction le degré d’oxydation de l’aluminium a passé de 0 à +3 : on dit qu’il s’est oxydé.
L’oxygène a passé du degré d’oxydation 0 à -2 : on dit qu’il s’est réduit.
Oxydation
Réduction

Définitions
= élévation du degré d’oxydation
= perte d’électrons
= abaissement du degré d’oxydation
= gain d’électrons
La réaction d’oxydation de l’aluminium par l’oxygène donne comme nous l’avons vu un oxyde d’aluminium: l’alumine, qu’on trouve dans le minerai appelé bauxite.

Réaction d’oxydation sans oxygène
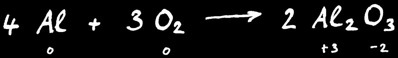
D’après notre définition de l’oxydation, nous pouvons imaginer d’autres réactions d’oxydation de l’aluminium en utilisant d’autres éléments relativement plus électronégatifs. Si nous plongeons une feuille d’aluminium dans une solution aqueuse contenant un sel de cuivre comme le sulfate de cuivre, l’aluminium est oxydé en quelques minutes, sans oxygène.
temps = 0
temps = 5 mn
temps = 10 mn
temps = 15 mn
Explications:
1.
2.
3.

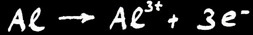
La réaction que nous venons de décrire se produit spontanément alors que la réaction inverse n’a pas lieu. En effet, si l’on trempe un morceau de cuivre dans une solution de sulfate d’aluminium, l’oxydation du cuivre n’a pas lieu. Pourquoi?
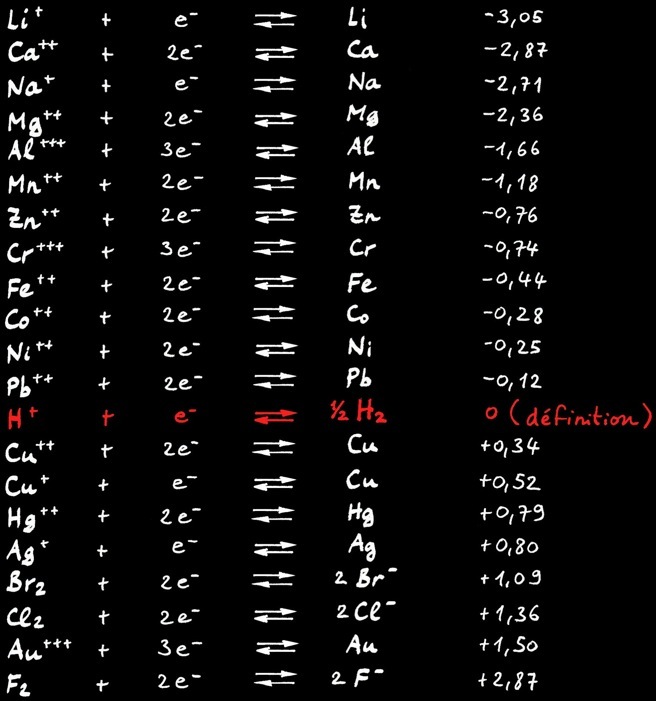
Le cuivre est plus électronégatif que l’aluminium, donc plus avide d’électrons. Ces transferts d’électrons peuvent être mesurés au moyen d’un voltmètre. Le potentiel électrique exprimé en [ Volt ] est plus pratique à manier pour prévoir le sens spontané des réactions d’oxydo-réduction.

Sens des réactions
Dans le tableau suivant, l’élément qui a le potentiel le plus élevé oxyde l’autre.
Métaux nobles
Métaux attaqués par l’ion acide H+

Cette page est en travaux. Bientôt la suite...
L’oxygène est toujours au degré d’oxydation -2
6.

Introduction


Rappel
Degré d’oxydation



Suite du cours: Piles et accumulateurs
Retour au portail des sciences



Retour au portail de chimie






La pièce de monnaie rongée

Expérience




Tous les métaux dont le potentiel d’oxydoréduction est inférieur à zéro volt (0V) sont oxydés, rouillés et rongés par les acides. En effet l’ion hydrogène H+, caractéristique des acides, est un attracteur d’électrons. Les métaux qui résistent aux acides (métaux nobles) ont un potentiel redox supérieur à 0V.
