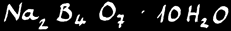Fabrication de slime



Préparation de 2 solutions:
A.Solution de 50 mL de borax à 4% (de la masse)
soit 4 grammes pour 100 grammes) :
Mettre 2 g de borax dans un bécher et rajouter 50 mL d’eau.
Dissoudre le borax et brasser lentement.
Rajouter une goutte de colorant (facultatif)
La solution réalisée correspond à 10 portions de 5 mL.
B.Solution de PVA à 4% :
Chauffer 50 mL d'eau dans un bécher 100 mL (entre 70 et 80°C) :
l’eau ne doit pas bouillir.
Verser lentement 2 g de PVA en brassant doucement pour dissoudre la plus grande partie des grumeaux.
Laisser refroidir la solution B
Prendre 5 mL de la solution A avec une seringue et l'ajouter à solution B en brassant continuellement.

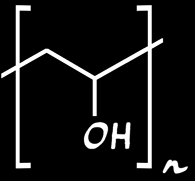
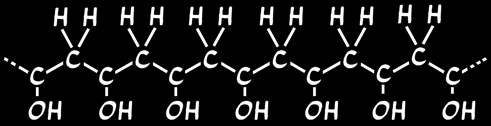
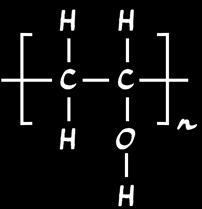
Le slime est un gel gluant. C'est un polymère produit à partir d'alcool polyvinylique (PVA). Sa formule chimique s'écrit:
Attention ! Il ne faut pas inhaler (respirer) les poudres réactives.
Comportement mécanique du Slime: Il se casse si on le brusque, mais coule très lorsqu'on l’étire lentement.
Le borax est très soluble. Même dans l’eau froide.
Le PVA est peu soluble: on utilise de l’eau chaude et il faut brasser un moment.
Le PVA en solution peut être comparé à de longs spaghetti microscopiques baignant dans de l'eau. C'est un liquide assez visqueux. Le borax joue le rôle de liaison entre les chaînes de PVA, comme du fromage entre les spaghetti. On appelle ceci une réticulation. Les liaisons sont de deux types: des liaisons chimiques solides (liaisons covalentes dessinée en traits pleins) et des liaisons assez souples appelées liaisons hydrogène (dessinée en traits tillés)
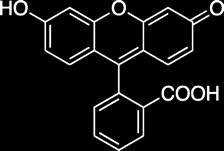
On peut utiliser des colorants tels que la fluorescéine (jaune fluorescent), le bleu de méthylène (bleu) ou n'importe quel colorant alimentaire.
Retour au portail de chimie





Fin de la page
Retour au portail des sciences







•
•
•
•
•
•

Introduction

Matériel
•
•
•
•
•
•
•
•
Alcool polyvinylique (PolyVinyl alcool, PVA)
Tétraborate de sodium décahydraté ou borax : Na2B4O7 .10H2O
Colorant, fluorescéine (facultatif)
1 Baguette en verre
1 Bécher 50 mL
1 Bécher 100 mL
1 seringue 5 mL
1 balance analytique

Méthode
•
•
•

Remarques



Fluorescence

version avec la fluorescéine (jaune fluorescent)




lumière naturelle
éclairage UV
éclairage
UV + lumière blanche
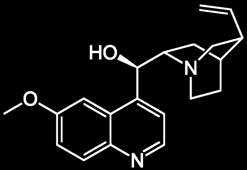
Le Schweppes contient de la quinine
qui est une substance fluorescente.