Solubilité et produit de solubilité



Suite du cours: l’oxydation
Retour au portail des sciences



Retour au portail de chimie




Suite du cours: les réaction réversibles







Les sels peu solubles
Jusqu'à présent, nous avons évité ce problème en choisissant des cas où les solutés étaient totalement solubles Nous allons aborder maintenant le cas des solutés "imparfaitement" solubles.
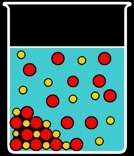
Des sels tels que le chromate ou le chlorure d'argent sont réputés insolubles. En réalité, une faible proportion de ceux-si restent en solution: on aboutit à un équilibre.
Etudions le cas d'une solution saturée en chlorure d'argent.

ne dépend que de la température. Pour le chlorure d’argent AgCl :
Remarque:
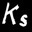


Fin de la page
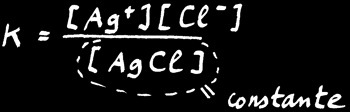
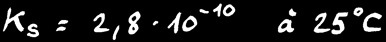

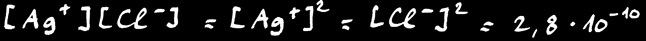
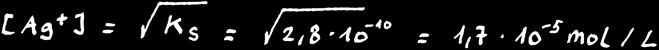


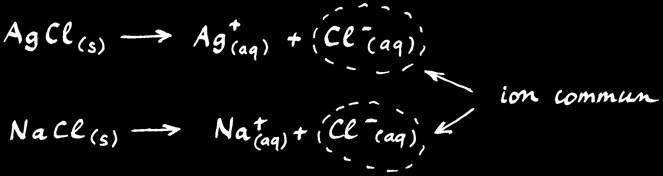
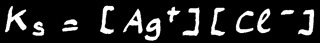

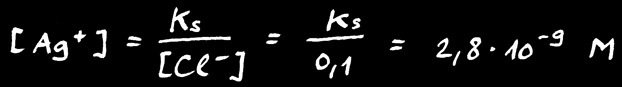

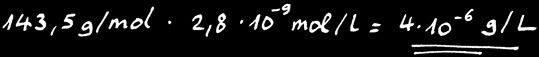

Lorsque nous plongeons un solide dans l'eau,
il peut se produire différents résultats:
3.
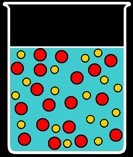
Le solide est soluble dans l'eau: il se dissout c'est à dire qu'il se désagrège. Il se fait "ronger" et disparait à notre vue mais on sait bien que ses constituants, invisibles, sont toujours là. Si je mets du sel de cuisine dans l'eau, je le vois disparaître lorsqu'il se dissout mais le sel est toujours là: l'eau a un goût salé. Dans ce cas on dit que le soluté (le sel) et le solvant (l'eau) forment un mélange homogène qu'on appelle une solution.
Le solide n'est pas soluble: il tombe au fond (s'il est plus dense que l'eau) ou alors il flotte (s'il est moins dense).
1.
2.
Le solide n'est pas totalement soluble: l'eau ne parvient à solubiliser qu'une partie du solide qui "passe en solution". L'autre partie reste intacte.
Lorsqu'on met du chlorure d'argent dans de l'eau pure, une partie se dissout et se dissocie en faisant apparaître les ions Ag+ et Cl-. On écrit la réaction:
AgCl --> Ag+ + Cl-
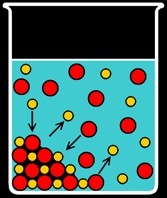
Très vite, l'eau ne parvient plus à dissoudre le sel: la réaction inverse a aussi lieu et on aboutit à un équilibre. La réaction est réversible et on l’écrit avec une double flèche:
AgCl <--> Ag+ + Cl-
Nous avons déjà vu qu'on peut appliquer à n'importe quelle réaction réversible (à l'équilibre) la loi d'action de masse :
[ Ag+ ] [ Cl- ] / [ AgCl ] = K
Mais comme la concentration d'un "solide pur dans un solide pur" est constante par définition, on peut alors noter que dans une solution saturée: [ AgCl ] = constante


On définit alors une nouvelle constante qu’on appelle le produit de solubilité.
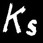
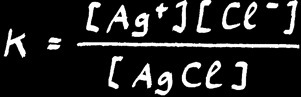

Ne pas confondre ...
La solubilité d’une substance représente la quantité (en moles ou en grammes) de ce corps dissous par litre de solution saturée.
Le produit de solubilité est le produit des concentrations des ions présents dans une solution saturée.
•
•


Calculons la solubilité de AgCl

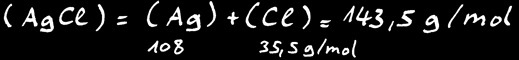
Connaissant la masse moléculaire de AgCl:
Nous pouvons calculer sa solubilité en gramme par litre:
On peut donc dissoudre au maximum 2,4 milligramme de AgCl dans 1 litre d’eau pure à 25 °C. Tout ce qu’on met en plus tombe au fond: on dit que le sel en surplus “précipite”.
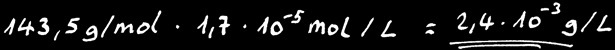

Problème de l’ion commun
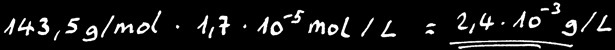
Nous savons calculer la solubilité d’un sel dans l’eau pure. Mais que se passe-t-il lorsque l’eau contient un autre sel?
Reprenons la solubilité de AgCl mais cette fois dans une eau qui contient déjà du NaCl (le sel de cuisine) à la concentration de 0,1 M (ou 0,1 mol/L). On écrit:
Le chlorure de sodiun NaCl se dissout et se dissocie en faisant apparaître les ions Na+ et Cl-. On voit que l’ion Cl- est aussi produit par la dissociation de AgCl. C’est un ion commun aux 2 sels.
Ecrivons le produit de solubilité de AgCl:
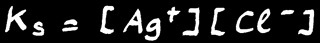
Le problème c’est qu’il y a déjà des ions Cl- apportés par le NaCl
NaCl s’est complètement dissout: si j’ai mis 0,1 mole de ce sel dans 1 litre d’eau alors la concentration de Cl- est égale à 0,1 mole par litre: on note [ NaCl] = [ Cl-] = 0,1 M
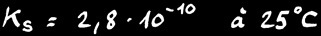

On se rappelle que :

Introduction
substance solide
eau




La solubilité de AgCl est divisée par 600 à cause de la présence de NaCl ou plutôt du ion Cl- à la concentration de 0,1 M.