Chimie des solutions


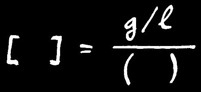
En chimie, on utilise une nouvelle notion: La concentration molaire ou molarité M

Définitions
Définition:
Exemple:
Une solution de H3PO4 0,1 M contient:
0,1 mole de H3PO4 , soit 0,1 ( H3PO4 )
= 0,1 x 98 g
= 9,8 g de H3PO4 par litre
Notation:
Une formule entourée du symbole [ ] représente la concentration molaire du composé formulé.
[ H3PO4 ] par exemple signifie «concentration molaire de H3PO4»
Lorsqu’on veut résoudre un problème relatif à des concentrations, il est utile de connaître la formule permettant de transformer des g / l en mole /l.
Avec:
= concentration molaire.


= nombre de grammes de soluté dissous par litre de solution.
= masse moléculaire du soluté.
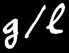
Lorsqu’on dissout un corps (appelé soluté) dans un liquide (appelé solvant), le mélange homogène qui en résulte est une solution. C’est une solution aqueuse si le solvant est l’eau (c’est souvent le cas, en chimie comme en cuisine).



solvant
soluté


La notion de concentration

solvant + soluté = solution
Nous avons tous une bonne idée de la façon de préparer un bon sirop. Trop concentré, le sirop est trop sucré. Trop dilué, il est fade.
Dans la soupe, c’est le même problème avec le sel. Le bon goût de la soupe dépend de la quantité de sel et d’eau .
La concentration est une grandeur qui représente la quantité de soluté par rapport à la quantité de solution.
Dans le langage courant, on utilise de nombreuses expressions:
% poids % volume ° (degré) g / L (gramme par litre) ppm (parties par million)

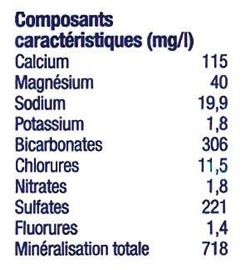
Exemple :
La concentration en sels d’une bouteille d’eau minérale est exprimée en mg/l (milligrammes de soluté par litre de solution)


Exemple :
La concentration en alcool d’une bouteille de bière est exprimée en % vol. (ici: 4,8 litres d’alcool pur dans 100 litres de bière)
Exemple :
Un alcool fort a une plus grande concentration en alcool. Ce whisky contient 0,4 l d’alcool pur par litre.


Concentration molaire
Une solution est dite x molaire, si elle contient x mole de soluté par litre de solution.


Exemple :
La teneur en matière grasse (Fett) dans la crème se mesure en % poids. Cette double crème contient 450 g / Kg soit 45% du poids (et non du volume).



Retour au portail des sciences



Retour au portail de chimie




Suite du cours: la solubilité







Fin de la page


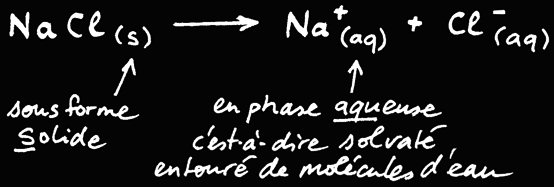
On pourrait écrire la réaction suivante:





Pourquoi l’eau dissout-elle le sel ?
L’eau à l’état liquide est un bon solvant. Mais pourquoi l’eau dissout-elle le sel et les électrolytes en général? Et pourquoi pas le sable? Pour répondre à ces questions il faut étudier la molécule d’eau d’un peu plus près.
Pour faire une molécule d’eau il faut:


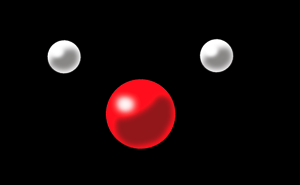

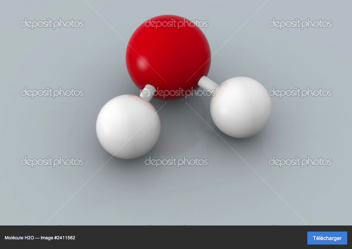


2 atomes d’hydrogène
1 atome d’oxygène





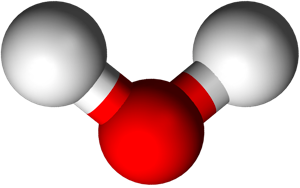
A eux 3 ils forment la molécule d’eau:

= nom chimique de l’eau


Une petite erreur s’est glissée dans cette image trouvée sur internet. Saurais-tu la trouver?
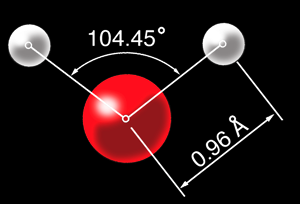
Petit détail: les liaisons chimiques forment un angle de 104,45°. On peut représenter la molécule d'eau de différentes façons:
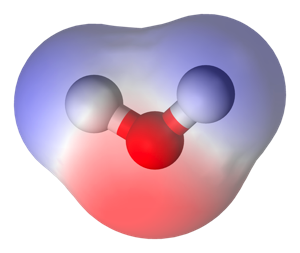
L'eau est un solvant polaire
C'est-à-dire qu'elle porte des charges électriques: l'oxygène est le pôle négatif et les hydrogènes forment le pôle positif. On note les charges "delta plus" et "delta moins". On dit que les liaisons entre O et H sont polarisées.
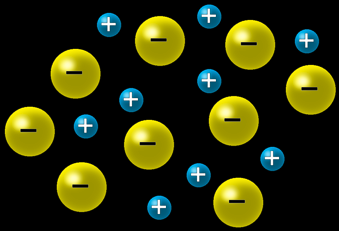
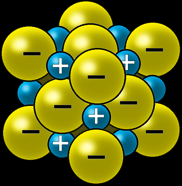
Le sel de cuisine NaCl est un cristal ionique, c'est-à-dire qu'il est formé d'atomes chargés qu’on appelle des ions.
Les ions sodium (Na) sont chargés positivement: ce sont des “cations” sodium qu’on note Na+.
Les ions chlore (Cl) sont chargés négativement: ce sont des "anions chlorure" qu’on note Cl-.
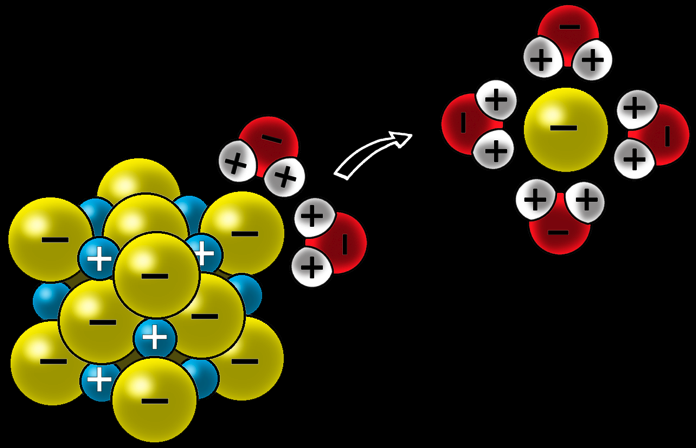
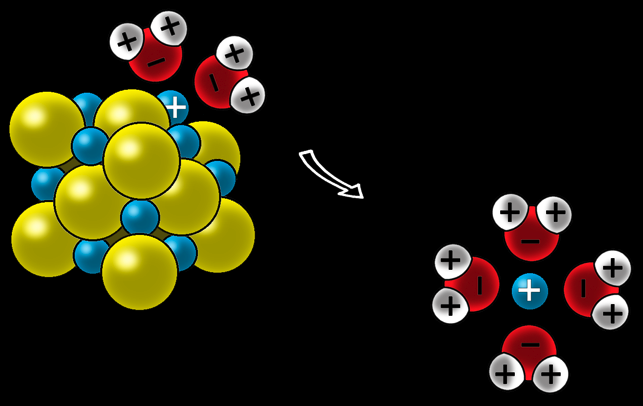
Dissolution du sel de cuisine dans l'eau
Pour dissoudre le sel, l’eau doit séparer les ions qui sont solidement liés. L'eau, grâce à ses charges partielles, attaque le cristal et arrache les ions.
Na
Cl
-
+



Na
+

Cl
-

Les ions de charges contraires s’attirent
Ils forment donc spontanément des assemblages compacts selon des formes géométriques simples qu’on appelle cristaux.
Les ions Cl- sont entourés par les charges positives des atomes d'hydrogène et arrachés du cristal.
Les ions Na+ sont entourés par les charges négatives des atomes d'oxygène et arrachés du cristal.
Ils restent en solution: on dit que les ions sont solvatés.
Ils restent en solution: on dit que les ions sont solvatés.
La dissolution du cristal de sel NaCl et la solvatation des ions Na+ et Cl- peuvent être représentées par une équation chimique:
attraction

Dissolution du sel de cuisine