Stoechiométrie

Nous avons vu qu’une équation chimique représente le bilan d’une réaction chimique. Lorsque nous brûlons du méthane, la réaction produit du dioxyde de carbone et de l’eau. On pourrait décrire cette réaction sous la forme:


Suite du cours: l’oxydation
Retour au portail des sciences



Retour au portail de chimie




Suite du cours: les réaction réversibles






Problèmes types de stoechiométrie
1. Teneur d'un corps
Quelle quantité de bore peut-on extraire à partir d'une tonne de borax Na2B4O7 . (H2O)10 si le rendement de l'opération est de 80% ?
Réponse : 92 [Kg]
2. Masse d'un corps
Combien faut-il prendre de grammes d'aluminium pour obtenir 1 tonne de chlorure d'aluminium selon la réaction : Al + Cl2 ---> AlCl3 (équilibrer l'équation)
Réponse : 2,02.105 [g] ou 202 [Kg]
3. Volume d'un corps participant à une réaction à TPN
Quel volume d'oxygène (gaz dioxygène) faut-il aux conditions normales de température et de pression pour transformer 100 [g] de fer en magnétite Fe3O4 ?
Réponse : 26,7 [L] ou 0,0267 [m3]
4. Volume d'un corps participant à une réaction si les conditions ne sont pas normales
Quel volume d'oxygène (gaz dioxygène) faut-il à 100 [°C] et 2 [atm] de pression pour brûler 270 [g] d'aluminium ?
Réponse : 114,7 [L] ou 0,114 [m3]
5. Composition centésimale d'un corps ( teneur en % )
Quelle est la composition centésimale du K2Cr2O7 ?
Réponse : 26,5 % de K _ 35,4 % de Cr _ 38,1 % de O
6. Formule d'un corps
Retrouver la formule d'un corps, connaissant sa composition centésimale ( donnée par l'analyse ) . Un acide organique a une masse moléculaire de 60 [g/mol]. Sa composition est 40 % de C _ 6,7 % de H _ 53,3 % de O . Quelle est sa formule ?
méthane + dioxygène ---> dioxyde de carbone + eau
Si on l’écrit avec des symboles chimiques, ça pourrait donner:
CH4 + O ---> CO2 + H4O
CH4 + O2 ---> CO2 + H2O
Mais cette équation est fausse: l’oxygène se trouve naturellement à l’état de molécule diatomique ( O2 ) et l’eau a pour formule H2O et non H4O. L’équation corrigée devient:
CH4 + 2 O2 ---> CO2 + 2 H2O
Cette équation est qualitativement juste : les 4 substances sont décrites au moyen de formules correctes mais si nous faisons le compte des atomes avant et après la réaction, on remarque que la loi de conservation de la matière est violée: notre réaction est quantitativement fausse.
CH4 + O2 ---> CO2 + H2O


4 H
2 H
2 O
2 + 1 = 3 O


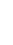
La stoechiométrie nous permet de transformer une équation qualitativement juste en une équation quantitativement juste en utilisant des coefficients :


Fin de la page