Texte




Les électrons ne sont pas rangés n'importe comment dans l'atome. Selon le modèle de Bohr, on les trouve sur des orbites (des niveaux d'énergie) un peu comme les planètes autour du soleil.
Les orbites sont désignées par des lettres : K,L,M,... ou plus logiquement par des chiffres 1, 2, 3, 4 , ... du centre vers la périphérie de l’atome.

Retour au portail des sciences



Retour au portail de chimie




Suite du cours: Modèles atomiques



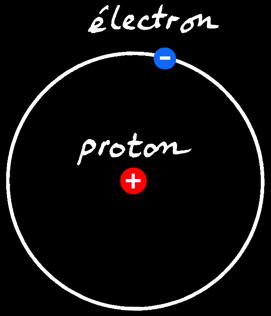

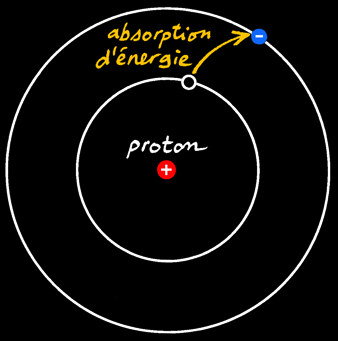

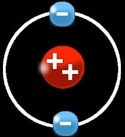
Prenons le cas de l'hydrogène atomique. C’est le plus simple:
Un électron tourne autour d’un proton.
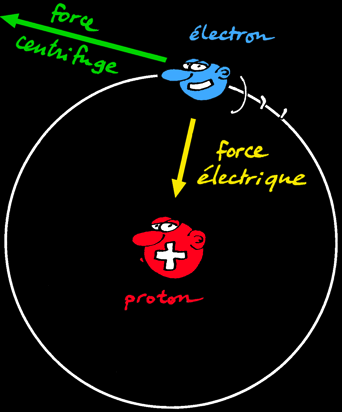
L'électron est chargé négativement tandis que le proton (et le noyau par conséquent) est chargé positivement. Un électron est donc lié à son atome par une force de nature électrique.
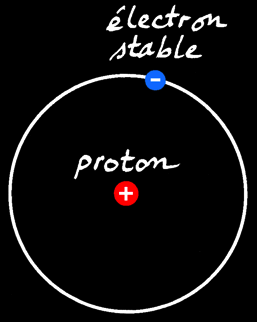
L'électron est donc en mouvement autour du noyau sur une orbite. Il occupe le niveau d'énergie le plus bas possible: c'est le niveau le plus stable. On l'appelle état fondamental.
L'électron peut recevoir une quantité d'énergie sous forme d'un photon, une particule - onde électromagnétique.
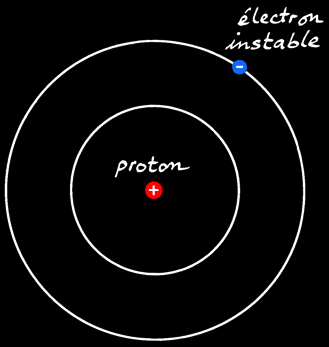
Si cette énergie est suffisante, l'électron peut l'absorber: il s'éloigne du noyau et occupe une autre orbite (moins stable): l'électron se trouve dans un état excité.
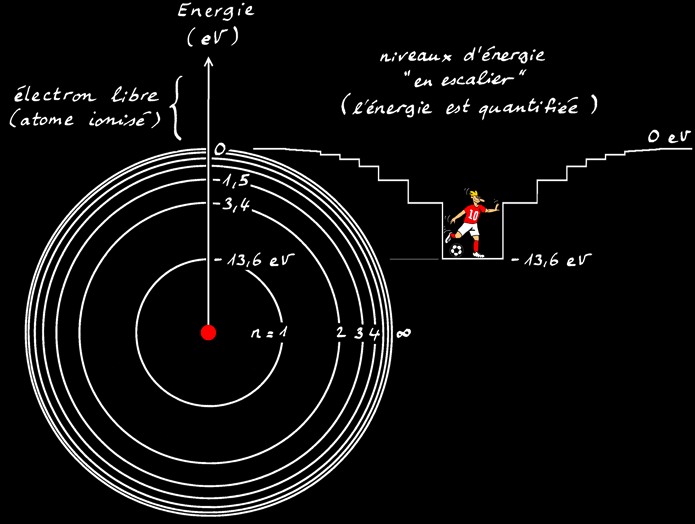

Transitions énergétiques
Construisons des atomes
Essayons de “construire” quelques atomes:

M
N ...
L
K

3
4 ...
2
1
La première orbite ( 1 ) peut contenir au maximum 2 électrons.
La deuxième orbite ( 2 ) peut contenir au maximum 8 électrons.
La troisième orbite ( 3 ) peut contenir au maximum 8 électrons.
La quatrième orbite ( 4 ) peut contenir au maximum 18 électrons.
....


En «retombant» à l'état fondamental, l'électron émet une quantité d'énergie correspondant à l'énergie qu'il avait reçue.


•
•
le noyau au centre de l’atome est représenté en rouge :
les électrons sont en bleu :


I
II
III
IV
V
VI
VII
VIII
1
2
3
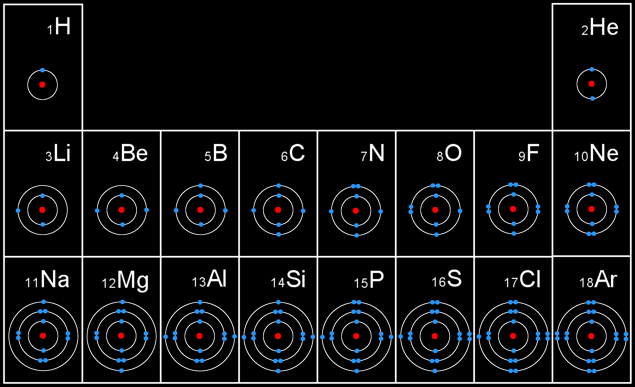
Remarque: Le nombre d’électrons sur la dernière couche (couche périphérique) correspond au numéro de la colonne du tableau périodique où l’élément se trouve.
L’hydrogène (H) a un numéro atomique = 1
Il a donc :
1 proton (+) dans le noyau
1 électron (-) sur la première orbite
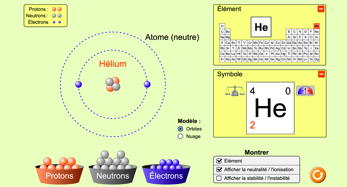
L’hélium (He) a un numéro atomique = 2
Il a donc :
2 protons (+) dans le noyau
2 électrons (-) sur la 1e orbite
La 1e orbite ne peut pas contenir plus de 2 électrons: elle est pleine.
Le lithium (Li) a un numéro atomique = 3
3 protons (+) dans le noyau
2 électrons (-) sur la 1e orbite
1 électron (-) sur la 2e orbite
Il a donc :
Le beryllium (Be) a un numéro atomique = 4
4 protons (+) dans le noyau
2 électrons (-) sur la 1e orbite
2 électrons (-) sur la 2e orbite
Il a donc :
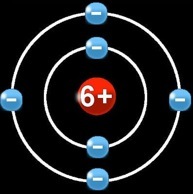
Le carbone (C) a un numéro atomique = 6
Il a donc :
6 protons (+) dans le noyau
2 électrons (-) sur la 1e orbite
4 électrons (-) sur la 2e orbite
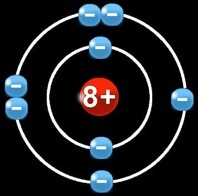
L’oxygène (O) a un numéro atomique = 8
Il a donc :
8 protons (+) dans le noyau
2 électrons (-) sur la 1e orbite
6 électrons (-) sur la 2e orbite
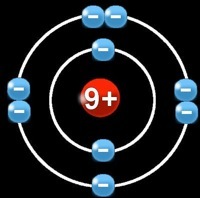
Le chlore (Cl) a un numéro atomique = 9
9 protons (+) dans le noyau
2 électrons (-) sur la 1e orbite
7 électrons (-) sur la 2e orbite
Il a donc :
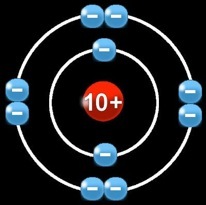
Le néon (Ne) a un numéro atomique = 10
Il a donc :
10 protons (+) dans le noyau
2 électrons (-) sur la 1e orbite
8 électrons (-) sur la 2e orbite
La 2e orbite ne peut pas contenir plus de 8 électrons: elle est pleine. On peut continuer en remplissant la 3e orbite qui contient au maximum 8 électrons.
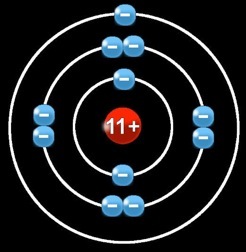
Le sodium (Na) a un numéro atomique = 11
11 protons (+) dans le noyau
2 électrons (-) sur la 1e orbite
8 électrons (-) sur la 2e orbite
1 électron (-) sur la 3e orbite
Il a donc :
On peut représenter les 18 premiers éléments dans un tableau comportant 8 colonnes et 3 lignes (on dit 3 périodes): c'est le tableau périodique des éléments.

Energie d’ionisation

L’énergie d’ionisation est l’énergie qu’il faut fournir pour arracher un électron à l’atome auquel il est lié. L’atome (neutre) qui perd un électron (chargé négativement) devient un ion positif c’est-à-dire un atome chargé positivement.
Pourquoi faut-il fournir de l’énergie pour “shooter” un électron hors de l’atome? Il ne peut pas partir tout seul?
Réponse: un électron(-) et un proton (+) s’attirent par une force électromagnétique. Il faut donc vaincre cette force pour les séparer.
Pourquoi cette courbe est-elle si compliquée? En dents de scie?
Réponse: les atomes ont des propriétés périodiques.
Pourquoi est-ce si difficile d’arracher un électron à l’hélium (He), au néon (Ne),...?
Réponse: la configuration électronique “parfaite” des gaz rares en fait des atomes très stables, donc très difficiles à déstabiliser: il faut fournir beaucoup plus d’énergie.
Pourquoi l’énergie d’ionisation du lithium (Li), du sodium (Na) ,... est-elle plus faible?
Réponse: les atomes de métaux alcalins (1ere colonne du tableau périodique) ont tendance à laisser partir facilement 1 électron: ils acquièrent ainsi la même configuration électronique qu’un gaz rare, et ça les stabilise!
Pourquoi faire des piles au lithium?
Réponse: le lithium cède facilement un électron qui peut circuler dans un circuit électrique. On peut écrire l’équation:
1.
2.
3.
4.
5.
•
•
•
•


orbite stable correspondant à l’état fondamental
orbite correspondant à l’état excité




Spectres atomiques
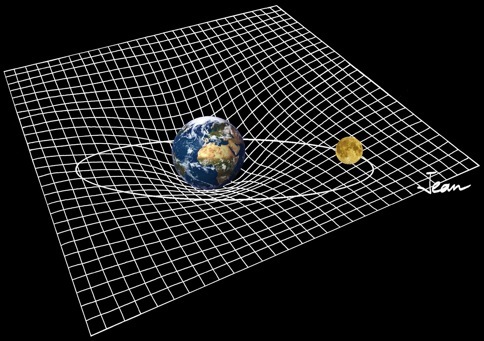
On se rappelle que la lune est aussi liée à la Terre, mais par la force gravitationnelle (ou gravitation).
S'il reçoit assez d'énergie (l'énergie d'ionisation qui vaut 13,6 eV dans le cas de l'hydrogène), l'électron peut même quitter l'atome et devenir un électron libre. L'atome qui a perdu son électron devient un ion positif. On dit qu'il est «ionisé».
n=1
n=2
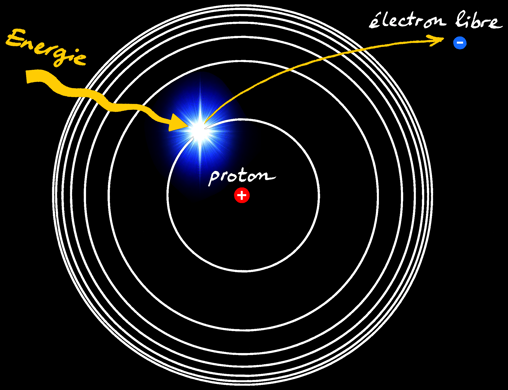




2 charges opposées s’attirent. Mais alors, pourquoi l’électron ne tombe-t-il pas sur le noyau?


Nous pouvons aussi diriger notre spectromètre sur un tube fluorescent : on observe alors le spectre discontinu de l’atome de mercure excité par le passage du courant.
Nous pouvons ainsi observer le spectre continu d’une ampoule à incandescence: toutes les longueurs d’onde sont présentes.
Parce que l’électron est en mouvement:
la force centrifuge qui en résulte compense exactement la force d'attraction électrique.
Au delà de cette orbite, l’électron n’est plus lié à l’atome: il est libre.

Les éléments de la colonne I
Les éléments de la colonne II
Les éléments de la colonne III
...
•
•
•
les éléments de la colonne VIII ont 8 électrons périphériques.
Ils sont plus stables que les autres. Ils sont peu réactifs. Ils ne participent pas aux réactions chimiques: on dit qu'ils sont inertes.
Les autres éléments doivent se stabiliser en imitant les gaz inertes de cette 8e colonne. Pour cela ils doivent donner, recevoir ou partager des électrons.
•
ont 1 électron périphérique.
ont 2 électrons périphériques.
ont 3 électrons périphériques.
Les métaux alcalins (1e colonne du tableau périodique) ont tendance à laisser partir facilement leur unique électron périphérique: ils acquièrent ainsi la même configuration électronique qu’un gaz rare, et ça les stabilise!
Cette tendance à donner facilement un électron fait du lithium un bon candidat pour réaliser l’anode (pôle négatif) d’une pile (...au lithium)
Les gaz rares sont très stables. Leur couche électronique externe est pleine contrairement aux autres atomes. Il faut fournir beaucoup d’énergie pour les ioniser et ainsi les déstabiliser.
On voit bien dans la famille des gaz rares comment l’énergie d’ionisation diminue avec le numéro atomique: He > Ne > Ar > Kr > Xe > Rn
Pourquoi? Parce que dans cette série les atomes deviennent de plus en plus gros: l’électron périphérique est de plus en plus éloigné du noyau. Il est de moins en moins retenu par la force électromagnétique et on peut l’arracher plus facilement.


Leur configuration électronique “parfaite” des gaz rares en fait des atomes très stables, donc très difficiles à déstabiliser: il faut fournir beaucoup plus d’énergie.
atome
métallique
électron
ion positif

à l’anode
(pôle négatif)



anode au lithium (code C)
diamètre
20 mm
épaisseur
3,2 mm



tension nominale
accumulateur lithium-ion


Répondre aux questions en se basant sur le graphique.
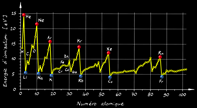
Comment l’énergie d’ionisation varie-t-elle dans la famille des gaz rares?
Réponse: elle diminue avec le numéro atomique: He > Ne > Ar > Kr > Xe > Rn
Pourquoi? Parce que dans cette série les atomes deviennent de plus en plus gros: l’électron périphérique est de plus en plus éloigné du noyau. Il est de moins en moins retenu par la force électromagnétique et on peut l’arracher plus facilement.
6.
atome
métallique
électron
ion positif

à l’anode
(pôle négatif)

Dans une pile, il faut un donneur d’électrons au pôle (-) et un accepteur d’électrons au pôle (+)







pôle -
(fond plat)
pôle + (bouton)
pôle -
pôle -
pôle -
pôle +
pôle +
pôle +








Rappels:



Nous pouvons analyser l’émission d’une source lumineuse grâce à un spectroscope.
un atome est constitué de diverses particules : protons(+), neutrons (0) et électrons (-). Ces particules restent ensemble grâce à différentes forces:
la force nucléaire assure la cohésion des particules de noyau (“nucleus” en latin): les protons et les neutrons restent collés ensemble !
la force électromagnétique lie chaque électron (-) au noyau (+).
1 eV (1 électron-volt) est l’énergie acquise par un électron soumis à une différence de potentiel de 1 Volt.

Lorsqu’on excite un atome, qu’on lui fournit assez d'énergie, les électrons peuvent absorber une partie de cette énergie pour changer de couche. Lorsqu’ils regagnent leur couche stable, ils émettent une série de radiations bien définies.
On peut imaginer un atome comme un «puit en escalier». Le petit footballeur au fond de son puit doit fournir une quantité d’énergie bien déterminée (quantifiée)pour que son ballon passe d’une marche à l’autre.
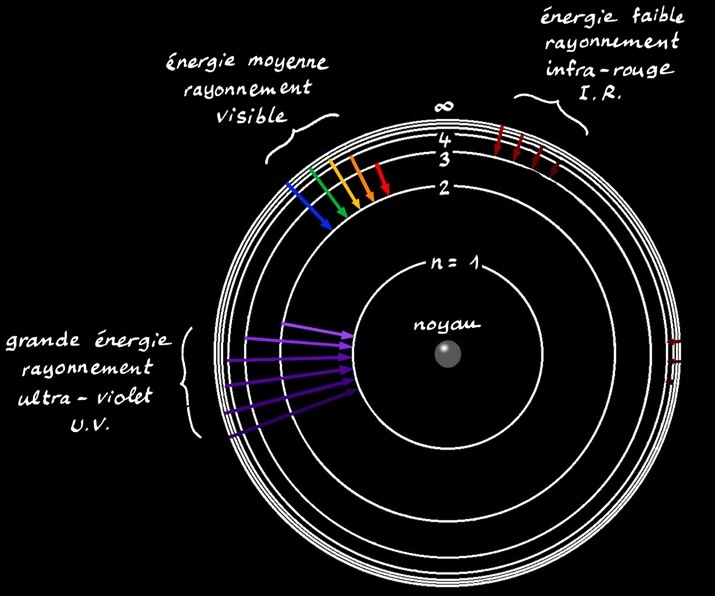
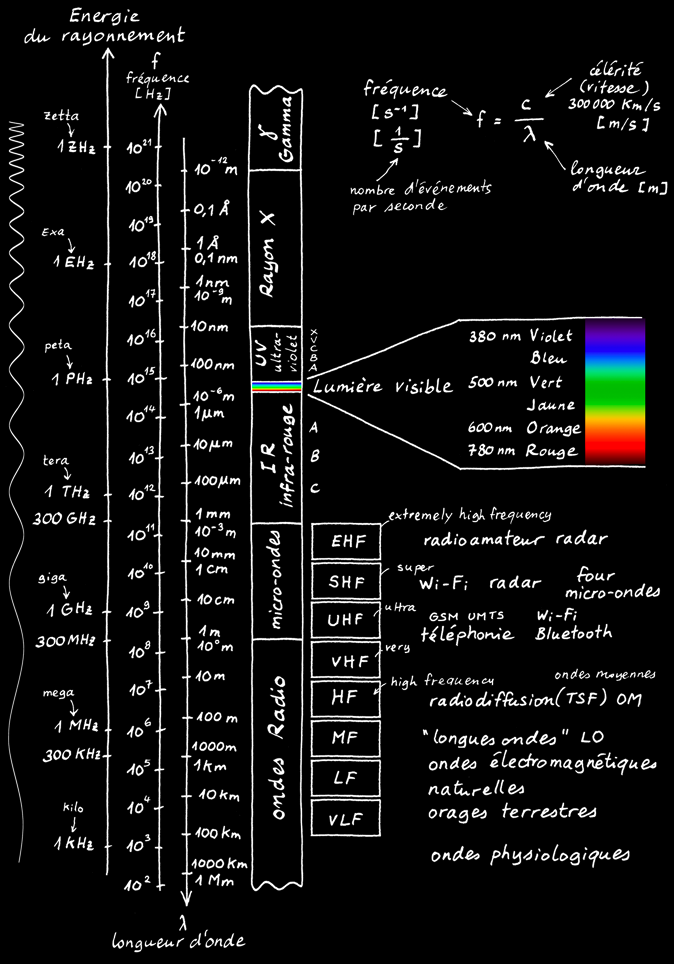
La fréquence du rayonnement ou sa longueur d’onde permet de définir les différents domaines du spectre :
On peut compliquer un peu les choses afin de mieux définir les familles de radiations:
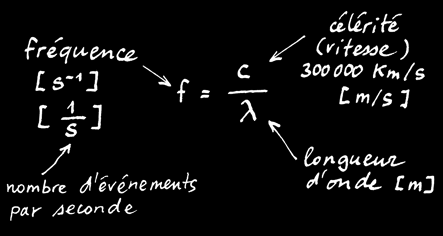
Pour mémoire, il existe une relation simple qui lie la fréquence d’une onde et sa longueur d’onde:
On remarque au passage que la lumière ne représente qu’une petite partie du spectre électromagnétique.
Si nous revenons à l’atome, nous remarquons que les différents sauts énergétiques des électrons correspondent évidemment à des familles de rayonnement différents.
La lumière entre par une petite fente
à l’une de ses extrémités

Cette lumière est ensuite envoyée sur un prisme: celui-ci sépare les différents constituants du mélange d’ondes par diffraction :

Chaque élément chimique signe sa présence par un spectre différent
Les applications du spectroscope sont nombreuses. On peut comparer le spectre d’un atome inconnu avec celui déjà étudié en laboratoire. On peut même connaître la composition chimique d’une étoile éloignée de milliards de kilomètres en restant sur Terre.




Une animation permet de «construire des atomes»
L’énergie E du rayonnement émis par un électron qui «tombe» de la couche électronique n=2 à la couche électronique n=1 peut s’écrire:
Cette énergie est égale à la fréquence de l’onde multiplié par une constante : la constante de Planck h. On peut retenir:

constante de Planck
fréquence

énergie du rayonnement

Nous connaissons bien les manifestations possibles des rayons électromagnétiques. On peut représenter simplement leurs principales «familles» le long d’un axe:







longues ondes
ondes courtes
•
•
basse fréquence
énergie faible
haute fréquence
énergie élevée
•
•

onde courte = haute fréquence = rayonnement énergétique
Animation «gaz»